4-Imidazolidinon
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| Allgemeines | ||||||||||
| Name | 4-Imidazolidinon | |||||||||
| Summenformel | C3H6N2O | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 86,09 g·mol−1 | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
4-Imidazolidinon ist eine chemische Verbindung und eines der beiden möglichen Imidazolidinone.
Gewinnung und Darstellung
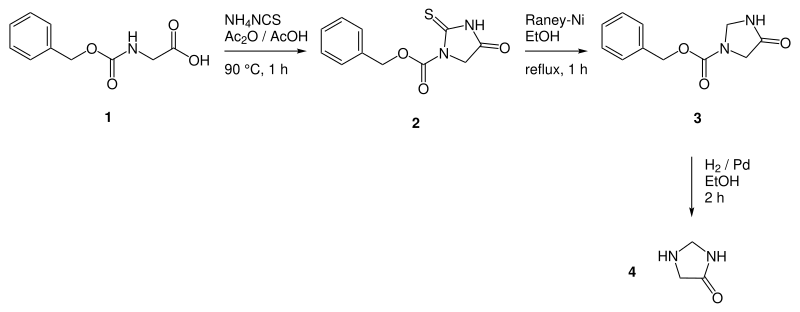
Nach Freter et al. 1957
4-Imidazolidinon kann in drei Schritten aus Carbobenzyloxyglycin[3] (1) hergestellt werden. Der erste Schritt ist eine Cyclokondensation des in situ generierten O-Acetats mit Ammoniumrhodanid, was zum Cbz-geschützten Thiohydantoin 2 führt. Dieses wird mit Raney-Nickel entschwefelt. Das somit vorliegende Zwischenprodukt 3 entspricht dem Cbz-geschützten Produkt (4). Die Abspaltung der Schutzgruppe erfolgt durch Hydrierung am Palladiumkatalysator. Zur Reinigung des Produkts wird aus wässrigem Ethanol umkristallisiert.[1]
Nach Pfeiffer et al. 1988
Eine ähnliche Synthese des 4-Imidazolidinons beginnt mit dem Edukt 2-Benzylaminoacetamid[4] (1). Hier wird die Cyclokondensation mit Formaldehyd durchgeführt, wobei allerdings das Halbaminal 2 erzeugt, welches in einem zweiten Schritt durch Erhitzen unter vermindertem Druck gespalten werden muss. Nach einer Vakuumdestillation im Kugelrohr kann schließlich das Benzyl-geschützte Produkt (3) am Palladiumkatalysator durch Hydrierung entschützt werden.[5]
Eigenschaften
Im Basischen zersetzt sich 4-Imidazolidinon zu Glycin; im Sauren zu Glycinamid.[6] Gegen Wasser (im Neutralen) ist es recht beständig.[1]
Siehe auch
Weblinks
Einzelnachweise
- ↑ a b c Freter, Kurt and Rabinowitz, Jesse C and Witkop, Bernhard: Labile Stoffwechselprodukte V. Zur Biogenese Des Formiminoglycins Aus 4 (5H)-Imidazolon. In: Justus Liebigs Annalen der Chemie. Band 607, Nr. 1, 1957, S. 174–187, doi:10.1002/jlac.19576070121.
- ↑ a b c Datenblatt bei BLD Pharmatech, Katalognummer: BD98042, abgerufen am 5. September 2022.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu N-Benzyloxycarbonylglycin: CAS-Nummer: 1138-80-3, EG-Nummer: 214-516-0, ECHA-InfoCard: 100.013.196, PubChem: 14349, ChemSpider: 13710, Wikidata: Q27101958.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2-Benzylaminoacetamid: CAS-Nummer: 39796-49-1, EG-Nummer: 609-744-6, ECHA-InfoCard: 100.120.618, PubChem: 433982, ChemSpider: 383787, Wikidata: Q72440548.
- ↑ U. Pfeiffer, M. Riccaboni, R. Erba, M. Pinza: A short synthesis of 4-imidazolidinone. In: Liebigs Annalen der Chemie. Band 1988, Nr. 10, 1988, S. 993–995, doi:10.1002/jlac.198819881011.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Glycinamid: CAS-Nummer: 598-41-4, EG-Nummer: 209-932-4, ECHA-InfoCard: 100.009.031, PubChem: 69020, ChemSpider: 62242, Wikidata: Q27094555.