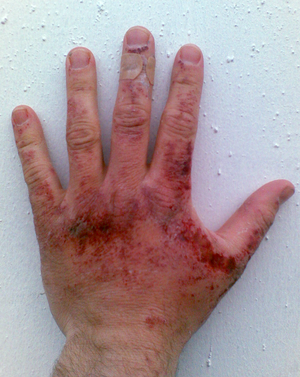
Alkalische Lösung
Alkalische Lösungen, die auch als Laugen bezeichnet werden, sind wässerige Lösungen, in denen die Konzentration der Hydroxid-Ionen OH− die der Oxonium-Ionen H3O+ übersteigt, was einen pH-Wert der Lösung von größer als 7 zur Folge hat. Um Aussagen etwas genauer zu machen, sind auch abgestufte Bezeichnungen wie schwach, oder sehr schwach alkalisch oder stark alkalisch üblich, wobei stark alkalische wässrige Lösungen üblicherweise einen pH-Wert von höher als 10 haben. Zum Beispiel hat eine Natronlauge, die 4 g Natriumhydroxid (NaOH) in 100 mL Wasser enthält den höchst möglichen pH-Wert von 14. Solche stark alkalischen Lösungen, die man dann auch als starke Laugen bezeichnet, können menschliche und tierische Hautoberflächen schon nach kurzer Einwirkung stark schädigen. Diese stark alkalischen Lösungen sind aber nur aus den mehr oder weniger gut in Wasser löslichen Metalloxiden der Alkalimetalle und der Erdalkalimetalle herstellbar, die man deshalb auch als basische Oxide bezeichnet. Diese Oxide bilden bei Reaktion mit Wasser die entsprechenden gut in Wasser löslichen Metallhydroxide der Alkali- und Erdalkalimetalle, die dann die hohen pH-Werte verursachen.
Die Oxide und auch die Hydroxide aller anderen Metalle sind in Wasser so schwer löslich, dass keine alkalischen Lösungen gebildet werden.[1]
Der Begriff Lauge, der auf die früher beim Waschvorgang verwendeten Seifenlösungen zurückzuführen ist und von daher mit einem glitschigen, seifigen Gefühl und mit einer Reinigungswirkung verbunden war, kann auch heute noch für wässerige Lösungen von Basen verwendet werden. Üblich ist die Bezeichnung im Bereich der Chemie aber nur im Fall von Natronlauge und Kalilauge, die bei Textilien eher zerstörende Wirkungen haben als Reinigungswirkung. Auch eine wässerige Lösung von Ammoniak, die als Ammoniakwasser bezeichnet wird und Lösungen ähnlicher basischer organischer Verbindungen wie z. B Amine, deren Lösungen in Wasser ebenfalls ph-Werte höher als 7 annehmen, könnten als Laugen bezeichnet werden, was aber nicht üblich ist. Nichtwässerige Lösungen von organischen basischen Substanzen können nicht als Laugen bezeichnet werden, da der pH-Wert nur für wässerige Lösungen definiert ist und auch ein glitschiges Hautgefühl an das Vorhandensein von Wasser gebunden ist. Im Alltag werden auch die schwach alkalischen Lösungen von Seifen und Waschmitteln in Wasser als Laugen bezeichnet.
Eigenschaften
Alkalische Lösungen fühlen sich auf der Haut glitschig (seifig, schmierig) an. Das geschieht durch Verseifung der Fette an der Hautoberfläche. An und abseits der Haut wirken Laugen entfettend; einerseits durch die kontinuierliche Bildung von Seifen aus Fett und andererseits durch die fettlösenden Eigenschaften der Seifen.
- Die sauren Lösungen von Sauren und die alkalischen Lösungen von Laugen besitzen insofern ähnliche Eigenschaften, als sie wegen vorhandener freibeweglicher Ionen elektrische Leitfähigkeit zeigen.
- Beide Arten von Lösungen können mit Indikatorfarbstoffen charakteristische Färbungen erzeugen.
- Beide Arten von Lösungen sind ätzend. Daher muss Hautkontakt vermieden und beim Arbeiten mit diesen Lösungen müssen stets Handschuhe und eine Schutzbrille getragen werden.
- Stark alkalische Lösungen sind ätzend, können Proteine auflösen, und sogar das Metall Aluminium zu Aluminiumhydroxid umsetzen. Bei längerem Einwirken und erhöhten Temperaturen greifen alkalische Lösungen auch Glasoberflächen an, was zur Trübung der Gläser führen kann. Die Handhabung von Natronlauge etc. in Glasgefäßen wie Erlenmeyerkolben ist dennoch möglich, solange keine Schliffstopfen aus Glas verwendet werden, da diese sich bei längerem Lagern festsetzen können.
Verwendung
Alkalische Lösungen werden unter anderem verwendet, um Nahrungsmittel zu pökeln und zu konservieren. Laugen werden auch beim Backen von Brezeln oder Laugenbrötchen eingesetzt, um braunglänzende Oberflächen zu erzeugen.
Bei der Herstellung von Arzneimittel verwendete man im Mittelalter gelegentlich aus Waidasche oder Weinreben hergestellte Lauge.[2]
In der Technik und der chemischen Produktion werden Laugen verwendet, um Säuren zu neutralisieren. Oder zur Entfernung von Fetten, wie vor der Gerbung.
Herstellung alkalischer Lösungen
Herstellung von wässrigen Alkalimetallhydroxidlösungen
Folgende Reaktionen, die jeweils mit Beispiel angeführt sind, führen zur Bildung wässriger Lösungen von Alkalimetallhydroxiden:
Lösen des entsprechenden Hydroxids in Wasser
Dies ist die einfachste Methode für die praktische Verwendung der Lösungen im Labor. Die Wärmeentwicklung beim Lösen (exotherme Reaktion) kann jedoch so stark sein, dass das Wasser zu sieden beginnt, wobei die alkalische Lösung verspritzen und zu Verätzungen führen kann. Beispiel:
- Natriumhydroxid + Wasser Natriumhydroxid - Lösung bzw. Natronlauge
- NaOH (s) + H2O (l) Na+ (aq) + OH− (aq) + H2O (l)
Reaktion eines Alkalimetalloxids mit Wasser
Es bildet sich bei Zugabe einer stöchiometrisch passenden Stoffmenge Wassers festes Alkalimetallhydroxid, bei Zugabe von Wasser im Überschuss eine Alkalimetallhydroxid-Lösung. Dabei erfolgt der in Herstellungsvariante 1 beschriebene Lösevorgang mit dem bei der Reaktion entstehenden Lithiumhydroxid. Beispiel:
- Lithiumoxid + Wasser Lithiumhydroxid
- Li2O (s) + H2O (l, stöchiometrisch) 2 LiOH (s)
- Lithiumoxid + Wasser Lithiumhydroxid - Lösung
- Li2O (s) + H2O (l, Überschuss) Li+ (aq) + OH− (aq) + H2O (l)
Reaktion eines Alkalimetalls mit Wasser
Wie bei der 2. Herstellungsvariante ist auch hier die zugegebene Stoffmenge Wasser entscheidend für die Entstehung bzw. Benennung des Produktes. Beispiel:
- Natrium + Wasser Natriumhydroxid + Wasserstoff
- 2 Na (s) + 2 H2O (l) 2 NaOH (s) + H2 (g)
Bei Zugabe von Wasser im Überschuss erfolgt der Lösevorgang des Natriumhydroxids aus Herstellungsvariante 1. In Abhängigkeit vom verwendeten Alkalimetall und der Versuchsdurchführung entzündet sich der entstehende Wasserstoff durch die frei werdende Reaktionswärme. Hochgeschwindigkeitsaufnahmen der Reaktion von Alkalimetallen mit Wasser legen eine Coulomb-Explosion nahe.[3]
Eine wichtige Variante ist die technische Produktion von Natronlauge durch die Reaktion von Wasser mit Natriumamalgam, welches man durch die Chlor-Alkali-Elektrolyse mit Quecksilberelektroden erhält.
Elektrolyse von Alkalimetall-Halogensalz-Lösungen
Durch die Elektrolyse von Kochsalzlösung wird großtechnisch Natronlauge hergestellt, wobei man durch eine poröse Trennwand (Diaphragma) weitgehend verhindert, dass sich die Kochsalzlösung und Natronlauge vermischen. Dadurch ist eine kontinuierliche Elektrolyse möglich:
- 2 Na+ (aq) + 2 Cl− (aq) + 2 H2O (l) 2 Na+ (aq) + 2 OH− (aq) + Cl2 (g) + H2 (g)
Weitere alkalische Lösungen
Kalkwasser (Kalklauge, gelöschter Kalk, Ca[OH]2) erhält man durch das Aufschlämmen von Calciumhydroxid oder das Löschen von Calciumoxid CaO, das als gebrannter (ungelöschter) Kalk günstig erhältlich ist.
Siehe auch
Einzelnachweise
- ↑ Theodore L. Brown, H. Eugene LeMay, Chemie. Ein Lehrbuch für alle Naturwissenschaftler| VCH VerlagsgesellschaftD6940 Weinheim, 1988, ISBN 3-527-26241-5, S. 475ff
- ↑ Gundolf Keil (Hrsg.): Das Lorscher Arzneibuch. (Handschrift Msc. Med. 1 der Staatsbibliothek Bamberg); Band 2: Übersetzung von Ulrich Stoll und Gundolf Keil unter Mitwirkung von Altabt Albert Ohlmeyer. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1989, S. 100.
- ↑ P. E. Mason, F. Uhlig, V. Vaněk, T. Buttersack, S. Bauerecker, P. Jungwirth: Coulomb explosion during the early stages of the reaction of alkali metals with water. In: Nature chemistry. Band 7, Nummer 3, März 2015, ISSN 1755-4349, S. 250–254, doi:10.1038/nchem.2161, PMID 25698335.