Americium(III)-fluorid
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| _ Am3+ _ F− | |||||||
| Kristallsystem | |||||||
| Raumgruppe |
P63/mmc (Nr. 194) | ||||||
| Gitterparameter |
a = 704,4 pm | ||||||
| Koordinationszahlen |
Am[9], F[3] | ||||||
| Allgemeines | |||||||
| Name | Americium(III)-fluorid | ||||||
| Andere Namen |
Americiumtrifluorid | ||||||
| Verhältnisformel | AmF3 | ||||||
| Kurzbeschreibung |
rosafarbene hexagonale Kristalle[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 300,06 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
9,53 g·cm−3[2] | ||||||
| Schmelzpunkt | |||||||
| Gefahren- und Sicherheitshinweise | |||||||
 Radioaktiv | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Americium(III)-fluorid ist ein Fluorid des künstlichen Elements und Actinoids Americium mit der Summenformel AmF3. In diesem Salz tritt Americium in der Oxidationsstufe +3 auf.
Darstellung
Americium(III)-fluorid kann durch die Umsetzung einer wässrigen Americiumlösung mit Fluoridsalzen im schwach Sauren hergestellt werden.
Im wasserfreien Zustand kann es ansonsten auch aus Americium(III)-hydroxid bei 600–750 °C in einem 1:1 Gasgemisch von HF/O2 hergestellt werden:[5]
Eigenschaften
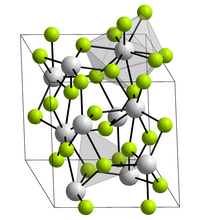
Americium(III)-fluorid ist ein rosafarbener Feststoff, der bei 1393 °C schmilzt.[3] Es kristallisiert in der Lanthanfluoridstruktur mit den Gitterparametern a = 704,4 pm und c = 722,5 pm.[6] Hierbei ist jeder Americiumkern von neun Fluorkernen in einer verzerrten dreifach-überkappten trigonal-prismatischen Struktur umgeben.
Verwendung
Metallisches Americium kann durch Reduktion aus Americium(III)-fluorid erhalten werden. Dieses wird hierzu in wasser- und sauerstofffreier Umgebung in Reaktionsapparaturen aus Tantal und Wolfram mit elementarem Barium zur Reaktion gebracht.[7][8]
Sicherheitshinweise
Einstufungen nach der CLP-Verordnung liegen nicht vor, weil diese nur die chemische Gefährlichkeit umfassen und eine völlig untergeordnete Rolle gegenüber den auf der Radioaktivität beruhenden Gefahren spielen. Auch Letzteres gilt nur, wenn es sich um eine dafür relevante Stoffmenge handelt.
Einzelnachweise
- ↑ a b L. B. Asprey, T. K. Keenan, F. H. Kruse: Crystal Structures of the Trifluorides, Trichlorides, Tribromides, and Triiodides of Americium and Curium, in: Inorg. Chem., 1965, 4 (7), S. 985–986 (doi:10.1021/ic50029a013).
- ↑ Americium(III)-fluorid bei www.webelements.com.
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1969.
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieser Stoff entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Sherman Fried: The Preparation of Anhydrous Americium Compounds, in: J. Am. Chem. Soc., 1951, 73 (1), S. 416–418 (doi:10.1021/ja01145a135).
- ↑ Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Transurane, Teil C, S. 102.
- ↑ Edgar F. Westrum, Jr., LeRoy Eyring: The Preparation and Some Properties of Americium Metal, in: J. Am. Chem. Soc., 1951, 73 (7), S. 3396–3398 (doi:10.1021/ja01151a116).
- ↑ Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Transurane, Teil B 1, S. 57–67.
Literatur
- Wolfgang H. Runde, Wallace W. Schulz: Americium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1265–1395 (doi:10.1007/1-4020-3598-5_8).


