Ammoniumnitrit
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
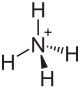 
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ammoniumnitrit | |||||||||||||||
| Summenformel | NH4NO2 | |||||||||||||||
| Kurzbeschreibung |
kleine Prismen[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 64,04 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Löslichkeit |
Zersetzung in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Ammoniumnitrit ist ein Ammoniumsalz der Salpetrigen Säure. Es besitzt die Formel NH4NO2.
Eigenschaften
Ammoniumnitrit bildet farblose nadelförmige Kristalle. Die Verbindung ist instabil und wird bereits bei Raumtemperatur sehr leicht durch Luftsauerstoff oxidiert, was durch eine hohe Luftfeuchtigkeit nochmals stark beschleunigt werden kann. Die Kristalle verfärben sich gelblich.
Gefahren
Erhitzt man das Ammoniumnitrit in seiner Kristallform, explodiert es ab einer Temperatur von 60–70 °C. Es reichen jedoch auch kleinere Stöße aus, um spontane Explosionen hervorzurufen.
Reaktionen
Ammoniumnitrit zerfällt zu Stickstoff und Wasser:
Verwendung
Ammoniumnitrit kann zur Synthese von Hydroxylamin verwendet werden. Ebenfalls eignet es sich als feste Stickstoffquelle, um beispielsweise Salze von NH2OH zu synthetisieren.
Einzelnachweise
- ↑ a b Eintrag zu Ammoniumnitrit. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. Juni 2014.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Ammonium nitrite im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 19. Juli 2019.
