Analatresie
| Klassifikation nach ICD-10 | |
|---|---|
| Q42.2 | Analatresie mit Fistel |
| Q42.3 | Analatresie ohne Fistel |
| ICD-10 online (WHO-Version 2019) | |
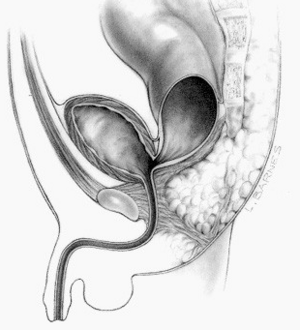
Die Analatresie oder lateinisch Atresia ani, allgemeiner anorektale Fehlbildung, ist eine angeborene Fehlbildung des Enddarms. Es fehlt dabei der Anus zum Ausscheiden des Darminhalts. Die Rektalatresie bezeichnet zusätzlich das Fehlen des unteren Teiles des Mastdarms.
Analatresien entstehen dadurch, dass der Durchbruch der Aftergrube in den Enddarm, der in der Regel bei Embryonen von 3,5 cm Länge erfolgt, ausbleibt.[1] Die Fehlbildung manifestiert sich bei jedem 3000. bis 5000. Neugeborenen oder bei 0,2–0,33 ‰.[2][3] Das sind in Deutschland zwischen 130 und 250 Kinder jährlich. In der Regel wird die Fehlbildung nach der Geburt diagnostiziert. Sie muss operativ behandelt werden. Die Anal- oder Rektalatresie ist häufig mit weiteren Fehlbildungen vergesellschaftet.
Geschichte
Die ältesten Überlieferungen von Beschreibungen und Behandlungen der Fehlbildung stammen aus dem Altertum. Der griechische Arzt Paulos von Aigina behandelte die Fehlbildung, indem er das Perineum (den Damm) wahrscheinlich an der Analgrube eröffnete. Durch die Öffnung konnte der Darminhalt nach außen gelangen. Diejenigen, die diesen Eingriff überlebten, litten an der tiefen Form der Fehlbildung, also nur an einer Analatresie, bei der der fehlende Darmabschnitt sehr kurz ist. Kinder mit der hohen Form (Rektalatresie) konnten auf diese Weise nicht erfolgreich behandelt werden.
Im Jahr 1710 hatte Alexis Littré vorgeschlagen, bei Analatresie einen künstlichen Darmausgang oberhalb des Hindernisses anzulegen. Antoine Dubois legte 1783 eine Zökalfistel bei einem Patienten mit Analatresie an.[4] Der Chirurg Jean Zuléma Amussat (1796–1856) entwickelte einen Vorläufer der noch heute angewendeten Durchzugsoperation. Seine Anorektoplastik wurde bis in die 1960er Jahre bei der hohen Form (Rektalatresie) angewendet. Anderenfalls griffen die Ärzte auf die Operation am Damm zurück. Viele Patienten blieben inkontinent. Eine wesentliche Neuerung war der Vorschlag der posterioren sagittalen Anorektoplastik von Alberto Peña. Nach einer 2002 verfassten Studie liegt die Zahl guter Ergebnisse bei 32–100 % bei der Operation nach Peña gegenüber 5–68 % bei der Durchzugsoperation.[5] Für hohe Formen wird heute laparoskopische Chirurgie eingesetzt.[6]
Häufigkeit
Die Zahlen zum Vorkommen der Fehlbildung schwanken stark. In verschiedenen Studien wurden zwei bis fünf Erkrankungen pro 10.000 Geburten ermittelt.[7] Im Basisbericht der „Gesundheitsberichterstattung Berlin“ sind für das Jahr 1999 0,25 Fälle pro 1000 Lebendgeburten angegeben. Levitt und Peña geben eine Erkrankung pro 5000 Lebendgeburten an.[3]
Männliche Neugeborene zeigen die Fehlbildungen häufiger als weibliche.[7] Über den Einfluss ethnischer Faktoren gibt es keine Klarheit. Das Ergebnis einer Studie aus dem Jahr 1995 ist, dass die Fehlbildung bei Menschen dunkler Hautfarbe häufiger vorkommt (Prävalenz).[8] In anderen Studien konnte dieses Ergebnis nicht bestätigt werden.[7]
Diagnose
Die Analatresie fällt dadurch auf, dass bei einem neugeborenen Kind der Anus fehlt, kein Fiebermessen möglich ist oder der Stuhl an einer atypischen Stelle (wie beispielsweise der Vagina) austritt. Bei Mädchen ist die Untersuchung von drei Öffnungen im Genitalbereich (Harnröhre, Vagina und Anus) von großer Bedeutung für die Therapie.
Eine Analatresie kann in der Schwangerschaft nur durch Begleitfehlbildungen diagnostiziert werden. Auch mit Feinultraschall oder im dritten Schwangerschaftstrimenon wird sie kaum erkannt. Durch eine Sonografie im dritten Trimenon soll es möglich sein, erweiterte Darmabschnitte oder einen Blindsack zu erkennen; in der praktischen Beobachtung wurden sie jedoch regelmäßig nicht erkannt. Eine Voraberkennung ist jedoch möglich, wenn zusätzlich andere Fehlbildungen (Skelett, Herz, Speiseröhre usw.) vorliegen. Insbesondere perineale Fisteln täuschen jedoch einen normalen Darmausgang vor und werden auch mehrere Monate oder Jahre nicht erkannt. Für diese perineale Form ist eine familiäre Häufung (bei 1 % auch in der Verwandtschaft) belegt; die anderen Formen treten in der Regel spontan auf.[9]
Nach der ersten Befunderhebung schließt sich eine perinaeale Sonographie zur Ermittlung der Distanz zwischen Rektumblindsack und Anus-Sollstelle sowie zum Ausschluss weiterer Fehlbildungen z. B. der Nieren und des Spinalkanals an.[2] Ein Fistelgang ist sonographisch in der Regel nicht darstellbar.[10]
Bei fehlender äußerlich erkennbarer Fistel vor und unzureichender Darstellung erfolgt eine radiologische Untersuchung nativ als Seitaufnahme des Beckens mit horizontalem Strahlengang in Bauchlage mit erhöhtem Becken, erst 16 bis 24 Stunden nach der Geburt sinnvoll, damit der Blindsack hinreichend luftgefüllt ist.[2] Bei sondierbarer Fistel wird die Untersuchung als Durchleuchtung mit einem Kontrastmittel durchgeführt. Eine Magnetresonanztomographie sowie andere Maßnahmen können im Rahmen der Diagnose ebenfalls eingesetzt werden.[11]
Wegen der Begleitfehlbildungen werden häufig weitere diagnostische Verfahren eingesetzt. Insbesondere zum Ausschluss oder Aufspüren eines vesikoureteralen Refluxes kann ein Miktionszystourethrogramm durchgeführt werden.
Klassifikation
Es existieren verschiedene Klassifikationen dieser Fehlbildung.[12] Santulli schlug die Unterscheidung in tiefe, intermediäre und hohe Fehlbildungen vor. Diese Klassifikation wird zum Teil heute noch verwendet. Sie geht jedoch nicht auf die große Vielfalt der Defekte ein. Daher sind heute die Klassifikationen nach Wingspread und Peña gebräuchlich.
| männlich | weiblich |
|---|---|
|
|
| männlich | weiblich |
|---|---|
|
|
Vorkommen
Folgende Erbkrankheiten sind mit einer Analatresie vergesellschaftet:
- Baller-Gerold-Syndrom
- Duane-Radial Ray Syndrom
- Embryofetopathia diabetica
- FG-Syndrom
- Johanson-Blizzard-Syndrom
- Katzenaugen-Syndrom
- Kaudales Regressionssyndrom
- Kurzripp-Polydaktylie-Syndrome
- McKusick-Kaufman-Syndrom
- Okihiro-Syndrom
- Sirenomelie
- Townes-Brocks-Syndrom
- VACTERL-Assoziation
Begleitfehlbildungen
Etwa die Hälfte der betroffenen Kinder hat weitere Fehlbildungen. Dabei sind die Begleitfehlbildungen bei der hohen Form häufiger und schwerwiegender als bei der tiefen Form.[7] Unten ist die Anzahl der Fälle von Begleitfehlbildungen aufgeführt. Die Zahlen sind abhängig von der Klassifikation der Fehlbildung und schwanken in verschiedenen Studien:
- Fehlbildungen des Urogenitaltraktes: 30–50 %
- Fehlbildungen des Magendarmtraktes: 4–8 %
- Wirbelfehlbildungen: 15–54 %
- Herzfehler: 9–11 %
- Fehlbildungen der Extremitäten: 18 %
- Ösophagusatresie: 10 %
- andere Fehlbildungen: 20 %
Pathologie

Die Ursachen der Fehlbildung sind bisher nicht geklärt. Forscher vermuten, dass die Ursachen von vielen Faktoren abhängen und dass genetische Faktoren eine große Rolle spielen[13]: Das Risiko, dass Geschwister eines Kindes mit Analatresie diese Fehlbildung ebenfalls aufweisen, liegt etwa bei 1:100, für die leichtesten Formen, während die Wahrscheinlichkeit sonst bei 1:3000 bis 1:5000 liegt. Cuschieri untersuchte über 1800 Patienten. Etwa zwei Drittel hatten neben anorektalen Fehlbildungen weitere Anomalien und 15 % wiesen genetische Defekte auf. Hauptsächlich fanden sich das Down-, das Edwards- und das Pätau-Syndrom. Eine weitere Gruppe von ebenfalls 15 % hatten VACTERL-Assoziation.
Therapie
Je nach Ausmaß der Fehlbildung wird zunächst ein Enterostoma (künstlicher Darmausgang) angelegt oder gleich eine operative Korrektur der Fehlbildung durchgeführt. Im erstgenannten Fall erfolgt die Hauptoperation im Alter zwischen drei und neun Monaten. Hierbei muss stets die komplette Fehlbildung korrigiert werden. Häufigste Operationsform ist das posterior-sagittale Vorgehen (posteriore sagittale Anorektoplastik) nach Peña-deVries, s. u. Nach einer angemessenen Wartephase wird das Enterostoma in einem letzten Schritt zurückverlegt. Die Operation kann auch schonend laparoskopisch erfolgen.[14]
Die ersten zwei Lebenstage sind entscheidend für die weitere Therapie. In dieser Zeit müssen eventuell vorhandene Begleitfehlbildungen diagnostiziert werden. Insbesondere ist dabei herauszufinden, ob diese das Leben des Neugeborenen gefährden und sofort zu behandeln sind. Weiterhin fällt hier die Entscheidung über die Anlage eines Anus praeter oder einer sofortigen Operation. Für diese Auswahl ist die Beobachtung aller Änderungen in den ersten 24 Lebensstunden sowie der physische Zustand des Neugeborenen und die An-/Abwesenheit eines Perineums wichtig.[15]
Für die Korrektur der Fehlbildung sind drei Operationsmethoden gebräuchlich:
- abdominoperineale Durchzugsoperation
- abdomino-sakroperinealen Durchzugsoperation nach Stephens
- posteriore sagittale anorektoplastische Operation
Die abdominoperineale Durchzugsoperation war bis Mitte des 20. Jahrhunderts das Standardverfahren zur Behandlung der Analatresie. Der Patient liegt während der Operation in Steinschnittlage, das Rektum wird mit einer Schlinge zum Perineum geführt und dort vernäht.
Bei der abdomino-sakroperinealen Durchzugsoperation nach Stephens erfolgt die Behandlung in Bauchlage. Die Schnittführung beginnt am Kreuzbein und endet im Perineum. Nach der Eröffnung wird der blind endende Darmanteil abgelöst, eine eventuell vorhandene Fistel (zur Scheide, zur Blase oder nach außen) geschlossen und das Darmstück durch den Musculus levator ani gezogen. Im Anschluss wird das Stück an die Haut angenäht. Bis Mitte der 1980er Jahre war dies die häufigste Behandlungsmethode bei Analatresie.
Peña und deVries verfeinerten die obigen Methoden und beschrieben das Verfahren als posteriore sagittale Anorektoplastik.[16] Derzeit ist es das Standardverfahren zur Behandlung der Fehlbildung. Die Operation erfolgt in Bauchlage. Der Schließmuskel wird einer Elektrostimulation unterzogen, um die vorhandene Kraft für die Kontraktion zu bestimmen. Diese Bestimmung kann als Indikator für spätere Kontinenz des Patienten benutzt werden. Im Gegensatz zum obigen Verfahren erfolgt die Schnittführung genau in der Mittellinie. Peña-deVries konnten hierdurch eine günstigere Prognose für Stuhlkontinenz nachweisen. Danach trennt der Operateur das Rektum vom Urogenitaltrakt, bis ausreichend Länge vorhanden ist, um es am Perineum zu anastomieren. Der Durchmesser des Anus ist nach der Operation zunächst kleiner, als für das Alter üblich wäre, und muss geweitet werden. Mit Hegarstiften unterschiedlicher Größe kann das Gewebe bis zur notwendigen Größe gedehnt werden. Dadurch bleibt die muskuläre Spannung zur Gewährleistung der Kontinenz erhalten.
Nachdem die erforderliche Weitung des Analkanals erreicht ist, wird das Enterostoma verschlossen. Dies geschieht üblicherweise drei bis vier Monate nach der Operation.
Nach der chirurgischen Therapie hat die Nachsorge durch die Eltern wesentlichen Einfluss auf das Kontinenzergebnis. Zu den Therapieoptionen gehören Physiotherapie (Beckenbodentraining), Ernährungsberatung, Medikamente, Stuhltraining, systematische Darmspülungen etc.
Nachsorge
Stuhlinkontinenz (unwillkürlicher Stuhlabgang) und/oder Obstipation (Verstopfung) kommen später bei vielen Kindern vor. Von sehr großer Bedeutung für die Lebenserwartung ist das Erkennen und die Therapie häufig gleichzeitig vorliegender Probleme des Harntraktes. Eine kontinuierliche Nachsorge in einem entsprechenden Zentrum ist daher für die Lebensqualität und Lebenserwartung der Kinder von großer Bedeutung. Teil der Nachsorge sollte es sein, soziale Kontinenz mittels multimodaler Therapieoptionen zu erreichen. Die Information zu sozialen und psychologischen Unterstützungsmöglichkeiten sollte wie bei allen potentiell chronisch sich auswirkenden Fehlbildungen beachtet werden, um die Chronifizierung zu vermeiden oder zu vermindern.
Prognose
Die Analatresie ist heute bei richtiger Diagnose und korrektem Vorgehen chirurgisch gut behandelbar. Die langfristige Prognose korreliert mit der Ausprägung der begleitenden Steiß- und Kreuzbeinagenesie. Mit einer regelmäßigen und umfassenden Nachsorge ist soziale Kontinenz fast immer erreichbar. Häufig gelingt es im Jugendalter wesentlich besser, die soziale Kontinenz zu steuern. Erfahrungen zu möglichen Schwangerschaften nach Kloakenfehlbildung liegen bisher noch kaum vor.
Weblinks
Einzelnachweise
- ↑ W. Stoeckel: Lehrbuch der Gynäkologie. 11. Aufl. Hirzel, Stuttgart 1947.
- ↑ a b c Leitlinie der Deutschen Gesellschaft für Kinderchirurgie zu anorektalen Fehlbildungen AWMF-Leitlinie, Reg. Nr. 006-002, Stand 2013, abgerufen am 7. November 2018
- ↑ a b Marc A. Levitt, Alberto Peña. Anorectal malformations (PDF; 2,3 MB). Orphanet Journal of Rare Diseases. 2007.
- ↑ Nikolaus Papastavrou: Darm. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 107–131, hier: S. 111.
- ↑ A. M. Holschneider, N. K. Jesch, E. Stragholz, W. Pfrommer: Surgical Methods for Anorectal Malformations from Rehbein to Peña – Critical Assessment of Score Systems and Proposal for a New Classification. In: European Journal of Pediatric Surgery. Band 12, Nr. 2, 2002, S. 73–82, doi:10.1055/s-2002-30166.
- ↑ Roman M Sydorak, Craig T Albanese: Laparoscopic repair of high imperforate anus. In: Seminars in Pediatric Surgery. Band 11, Nr. 4, November 2002, S. 217–225.
- ↑ a b c d Alexandra Werner. Anorektale Fehlbildungen, Dissertation an der Medizinischen Fakultät der Ludwig-Maximilians-Universität München. 2006 (PDF-Datei)
- ↑ Harris et al.: Descriptive epidemiology of alimentary tract atresia. Teratology. Volume 52 Issue 1, Pages 15–29. 1995
- ↑ Anorektale Fehlbildungen (Memento des Originals vom 19. Januar 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 3,6 MB). Kinderchirurgische Fortbildung der Universität Nijmegen
- ↑ V. Hofmann, K. H. Deeg, P. F. Hoyer: Ultraschalldiagnostik in Pädiatrie und Kinderchirurgie. Lehrbuch und Atlas. Thieme 2005, ISBN 3-13-100953-5
- ↑ W. Schuster, D. Färber (Herausgeber): Kinderradiologie. Bildgebende Diagnostik. Springer 1996, ISBN 3-540-60224-0
- ↑ William E. Ladd, Robert E. Gross: Congenital malformations of anus and rectum: Report of 162 cases. In: The American Journal of Surgery. Band 23, Nr. 1, Januar 1934, S. 167–183, doi:10.1016/S0002-9610(34)90892-8, PMID 5423060.
- ↑ Alfred Cuschieri: Anorectal anomalies associated with or as part of other anomalies. In: American Journal of Medical Genetics. Band 110, Nr. 2, 15. Juni 2002, S. 122–130, doi:10.1002/ajmg.10371.
- ↑ H. Koga, T. Ochi, M. Okawada, T. Doi, G. J. Lane, A. Yamataka: Comparison of outcomes between laparoscopy-assisted and posterior sagittal anorectoplasties for male imperforate anus with recto-bulbar fistula. In: Journal of pediatric surgery. Bd. 49, Nr. 12, Dezember 2014, S. 1815–1817, ISSN 1531-5037. doi:10.1016/j.jpedsurg.2014.09.028. PMID 25487490.
- ↑ Guochang Liu, Jiyan Yuan, Jinmei Geng, Chunhua Wang, Tuanguang Li: The treatment of high and intermediate anorectal malformations: One stage or three procedures? In: Journal of Pediatric Surgery. Band 39, Nr. 10, Oktober 2004, S. 1466–1471, doi:10.1016/j.jpedsurg.2004.06.021.
- ↑ Pieter A. deVries, Alberto Peña: Posterior sagittal anorectoplasty. In: Journal of Pediatric Surgery. Band 17, Nr. 5, Oktober 1982, S. 638–643, doi:10.1016/S0022-3468(82)80126-7, PMID 7175658.