Argininosuccinat-Synthase
aus Wikipedia, der freien Enzyklopädie
| Argininosuccinat-Synthase | ||
|---|---|---|
| Argininosuccinat-Synthase | ||
| Argininosuccinate synthetase tetramer, Thermus thermophilus nach PDB 1J1Z | ||
|
Vorhandene Strukturdaten: 2nz2 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 412 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homotetramer | |
| Bezeichner | ||
| Gen-Name | ASS1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 6.3.4.5, Ligase | |
| Reaktionsart | Addition | |
| Substrat | ATP + Citrullin + Aspartat | |
| Produkte | AMP + Diphosphat + Argininosuccinat | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen[1] | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 445 | 11898 |
| Ensembl | ENSG00000130707 | ENSMUSG00000076441 |
| UniProt | P00966 | P16460 |
| Refseq (mRNA) | NM_000050 | NM_007494 |
| Refseq (Protein) | NP_000041 | NP_031520 |
| Genlocus | Chr 9: 130.44 – 130.5 Mb | Chr 2: 31.47 – 31.52 Mb |
| PubMed-Suche | 445 | 11898
|
Die Argininosuccinat-Synthase (ASS) (auch Argininosuccinat-Synthetase) ist das Enzym, das die Umsetzung von Aspartat und Citrullin zu Argininosuccinat katalysiert. Diese Reaktion findet in allen Lebewesen bei der Biosynthese der Aminosäure Arginin statt und ist in Wirbeltieren Teil des Harnstoffzyklus. Mutationen im ASS1-Gen sind die Ursache für Citrullinämie Typ I.[2][3]
Die Regulation der leberspezifischen ASS-Expression findet über cAMP-Signalwege statt. In der Caco-2-Zelllinie agieren IL-1-beta und Stickstoffmonoxid als Gegenspieler der ASS-Regulation.[4][5]
Katalysierte Reaktion
Citrullin + ![]() + ATP ⇔
+ ATP ⇔
⇔ 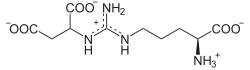 + AMP + PPi
+ AMP + PPi
Citrullin und Aspartat kondensieren zu Argininsuccinat.
Weblinks
Wikibooks: Harnstoffzyklus – Lern- und Lehrmaterialien
Einzelnachweise
- ↑ Homologe bei OMA
- ↑ UniProt P00966
- ↑ Engel K, Höhne W, Häberle J: Mutations and polymorphisms in the human argininosuccinate synthetase (ASS1) gene. In: Hum. Mutat.. 30, Nr. 3, März 2009, S. 300–7. doi:10.1002/humu.20847. PMID 19006241.
- ↑ Guei TR, Liu MC, Yang CP, Su TS: Identification of a liver-specific cAMP response element in the human argininosuccinate synthetase gene. In: Biochem Biophys Res Commun. 377, Nr. 1, Dezember 2008, S. 257–61. doi:10.1016/j.bbrc.2008.09.118. PMID 18840401.
- ↑ Brasse-Lagnel C, Lavoinne A, Fairand A, Vavasseur K, Deniel N, Husson A: Biphasic effect of IL-1beta on the activity of argininosuccinate synthetase in Caco-2 cells. Involvement of nitric oxide production. In: Biochimie. 88, Nr. 6, Juni 2006, S. 607–12. doi:10.1016/j.biochi.2005.11.005. PMID 16380201.