Aston-Greenburg-Umlagerung
Die Aston-Greenburg-Umlagerung ist eine Namensreaktion der Organischen Chemie.[1] Die Chemiker J. G. Aston und R. B. Greenburg berichteten erstmals 1940 über diese Reaktion.[1][2] Sie beschreibt die Umlagerung eines α-Halogenketons in einen Ester mit tertiärem α-Kohlenstoffatom.[1][2]
Die Umlagerung verläuft dabei über die intramolekulare Wanderung einer Alkyl- oder Aryl-gruppe.[1][2]
Übersichtsreaktion
Die Reaktion lässt sich unter anderem mit Natriummethanolat in Diethylether durchführen und läuft stereospezifisch ab.[2][3] Die Übersichtsreaktion wird an dieser Stelle vereinfacht am Beispiel der Reaktion von 3-Brom-3-methyl-2-butanon zu Methyl-trimethylacetat dargestellt, wobei die umgelagerte Methylgruppe blau markiert ist:
Reaktionsmechanismus
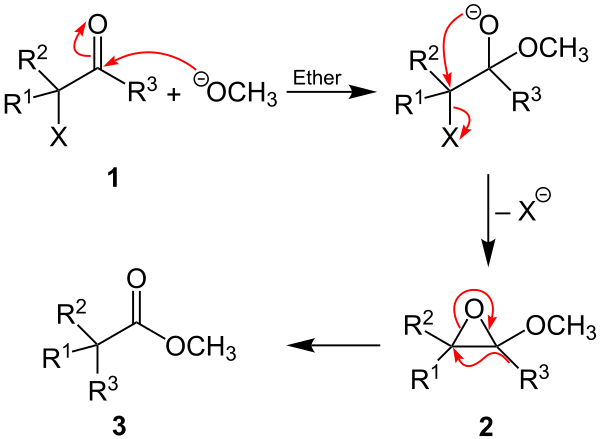
Der Reaktionsmechanismus ist nicht genau bekannt.[1] Es folgt ein vorgeschlagener Mechanismus, welcher der Favorskii-Umlagerung ähnelt.[1] Exemplarisch wird die Reaktion mit Natriummethanolat an einem nicht näher definierten α-Halogenketon durchgeführt (dabei sind mindestens R1 und/oder R2 und in jedem Fall R3 ein organischer Rest und X ein Halogen, wobei R3 in der Literatur als Alkyl- oder Arylgruppe beschrieben wird).[2] Im ersten Schritt erfolgt ein nukleophiler Angriff des Alkoxylats am positiv polarisierten Kohlenstoffatom der Ketogruppe des α-Halogenketons (1). Das Halogen wird anschließend als Anion unter Bildung eines Epoxids (2) abgespalten. Die Bildung des Esters (3) erfolgt abschließend über die intramolekulare Wanderung der Alkyl- beziehungsweise Arylgruppe (R3) und unter Ausbildung der Carbonylgruppe aus dem Epoxid:
Konkurrenzreaktion
In Diethylether läuft die Reaktion mit einer überwiegenden Ausbeute des Esters mit tertiärem α-Kohlenstoffatom ab.[2] Ein Zusatz des Alkohols, beispielsweise Methanol bei Einsatz von Natriummethanolat, kann zu einer Anlagerung eines Alkoholmoleküls an das Epoxid führen, wodurch die Umlagerung der Alkyl- beziehungsweise Arylgruppe ausbleibt.[2] Es entsteht ein Hydroxyacetal, nebenstehend als Reaktionsprodukt am Beispiel der Reaktion von 3-Brom-3-methyl-2-butanon und Natriummethanolat.[2] Bei der Durchführung der Reaktion in absolutem Alkohol bildet sich überwiegend das Hydroxyacetal mit einer geringen Ausbeute des Esters mit tertiärem α-Kohlenstoffatom.[2]
Atomökonomie
Die Atomökonomie dieser Reaktion lässt sich prinzipiell als effizient beurteilen, da im Rahmen von Umlagerungsreaktionen verhältnismäßig wenig Nebenprodukte entstehen. Aufgrund der Abspaltung des Halogens und das damit entstehende Natriumsalz (bei Verwendung von Natriumalkoholat) sind jedoch geringe Mengen entstehender Abfallprodukte zu berücksichtigen. Zudem senkt die mögliche Entstehung des Hydroxyacetals die Effizienz dieser Reaktion. Im Rahmen einer Claisen-Umlagerung ließe sich beispielsweise ein entstehendes Hydroxyacetal unter Reaktion mit einem Allylalkohol in einer E-stereoselektiven Reaktion weiterverwenden, wodurch die Wirtschaftlichkeit der Reaktion verbessert werden würde.[4]
Weblinks
Einzelnachweise
- ↑ a b c d e f Daniel Zerong Wang: Comprehensive Organic Name Reactions and Reagents. Band 1. John Wiley & Sons, Inc., John Wiley & Sons, Inc., Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 111–113 (englisch).
- ↑ a b c d e f g h i J. G. Aston, R. B. Greenburg: alpha-Bromo Secondary Alkyl Ketones. I. Reaction with Sodium Alcoholates. A New Synthesis of Tertiary Acids by Rearrangement. In: Journal of the American Chemical Society. Band 62, Nr. 10, 1940, S. 2590–2595, doi:10.1021/ja01867a003.
- ↑ C. R. Engel, G. Just: Steroids and Related Products. I. The Synthesis of 17 α-Methyldesoxycorticosterone. In: Journal of the American Chemical Society. Band 76, 1954, S. 4909–4914, doi:10.1021/ja01648a044.
- ↑ Takayanagi Hisao, Morinaka Yasuhiro: Highly Stereoselective Synthesis of Trisubstituted γ,δ-Unsaturated Acid and Aldehyde via Ketal Claisen Rearrangement. In: Chemistry Letters. Band 24, Nr. 7, 1995, S. 565–566, doi:10.1246/cl.1995.565.