Atorvastatin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Atorvastatin | ||||||||||||||||||
| Andere Namen |
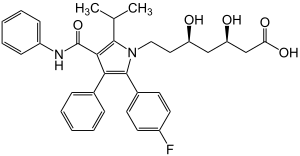
(3R,5R)-7-[2-(4-Fluorphenyl)-5-isopropyl-3-phenyl-4-(phenylcarbamoyl)pyrrol-1-yl]-3,5-dihydroxyheptansäure (IUPAC) | ||||||||||||||||||
| Summenformel | C33H35FN2O5 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Wirkmechanismus | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 558,65 g·mol−1 | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser (1,12 mg·l−1 bei 25 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Atorvastatin ist ein Arzneistoff aus der Gruppe der Statine, der zur Therapie der Hypercholesterinämie eingesetzt wird. Erstmals wurde er 1997 von Warner-Lambert als Sortis in den Handel gebracht, heute allerdings von Pfizer vertrieben. Seit Mai 2012 ist der Wirkstoff als Generikum in Deutschland erhältlich.[5] Entwickelt wurde der Arzneistoff 1985 von Bruce D. Roth.
Wirkmechanismus
Atorvastatin ist ein kompetitiver HMG-CoA-Reduktasehemmer. Die HMG-CoA-Reduktase wirkt als Katalysator bei der Reduktion des 3-Hydroxy-3-methylglutaryl-Coenzym A (HMG-CoA) zu Mevalonat, welche einen begrenzenden Schritt in der hepatischen Cholesterinsynthese darstellt.
Durch die Absenkung der Cholesterinsynthese steigern die Leberzellen die Anzahl der LDL-Rezeptoren auf der Zelloberfläche, sodass die LDL-Aufnahme in die Leberzelle erhöht und damit der LDL-Spiegel im Blut verringert wird.
Wirkstärke
Atorvastatin galt bis Anfang 2009 als in den eingesetzten Dosierungen (10 bis 20, selten bis 80 mg pro Tag[6]) als das am stärksten wirksame Statin auf dem deutschen Markt. Es ist etwa zwei- bis dreimal so stark wirksam wie Simvastatin (10 mg Atorvastatin entsprechen etwa 20–30 mg Simvastatin).[7] Stärker als Atorvastatin ist das auf dem deutschen Markt seit Januar 2009 verfügbare Rosuvastatin.[8]
Nebenwirkungen
Atorvastatin kann u. a. Störungen des Magen-Darm-Traktes (Durchfall, Verstopfung, Blähungen), Müdigkeit, Muskelschmerzen sowie Kopf- und Gelenkschmerzen verursachen.[9] Zu den schwerwiegenden, wenn auch seltenen, Nebenwirkungen gehören toxische Myopathien (Herzerkrankungen), die tödlich verlaufen können.[10]
Neuere Studien zeigen ein erhöhtes Diabetes-mellitus-Risiko durch Statine, wenn auch das Nutzen-Risiko-Verhältnis offenbar günstig ist.[11]
Marktbedeutung/Therapievorteile
Weltmarkt
Atorvastatin hatte 2008 auf dem weltweiten Statinmarkt einen Marktanteil von ca. 40–50 %. 2008 erbrachte es dem Unternehmen Pfizer einen Umsatz von 12,4 Milliarden Dollar.[13] 2011 war Atorvastatin auf Platz 1 der weltweit umsatzstärksten Medikamente, mit einem Umsatz von 12,264 Milliarden Dollar.[14]
Deutschland
Auf dem deutschen Markt lag der Marktanteil Ende 2003 bei etwa 50 %. Anfang 2004 trat eine Gesundheitsreform in Kraft, die für alle Statine einen Festbetrag vorgab. Die Firma Pfizer beschloss, die Preise für Sortis nicht an die Festbeträge anzupassen, sodass seitdem bei der Verordnung von Sortis eine höhere Zuzahlung für die Patienten anfiel. Begründet wurde diese Maßnahme seitens des Herstellers mit wirtschaftlichen Gründen im internationalen Zusammenhang. Infolge dieser Aktion sank nach Kassenangaben der Marktanteil der zu Lasten der gesetzlichen Krankenversicherung verordneten Sortis-Packungen in Deutschland 2005 auf unter 5 Prozent. Der Marktanteil bei den privaten Krankenversicherungen betrug im gleichen Zeitraum über 50 Prozent.[15] Am 7. Mai 2012 lief der Patentschutz für Atorvastatin aus; seit dem 8. Mai 2012 ist der Wirkstoff damit frei für Generikaanbieter. Da laut Studie mehr als 50 % der Patienten, die sich bereits in Therapie z. B. mit Simvastatin befinden, einen nicht ausreichend gesenkten LDL- und Gesamtcholesterinspiegel haben, ist Atorvastatin für Kassenpatienten mit einer besseren Wirksamkeit zu einem ähnlichen Preis eine Alternative.[16]
Handelsnamen
Sortis (D, A, CH); Atoris (D) und weitere Generika (D, A, CH)[17][18][19]
- mit Amlodipin: Caduet (A, CH) und Generika
- mit Ramipril und Acetylsalicylsäure: Sincronium (DE), Iltria (DE)
- mit Ezetimib: Atozet, Tioblis
Literatur
- U. Gresser, B. S. Gathof: Review: Atorvastatin: Gold Standard For Prophylaxis Of Myocardial Ichemia And Stroke. Comparison Of The Clinical Benefit Of Statins On The Basis Of Randomized Controlled Endpoint Studies. Eur. J. Med. Res. (2004) 9: S. 1–17.
Einzelnachweise
- ↑ a b Eintrag zu Atorvastatin in der DrugBank der University of Alberta
- ↑ a b c V. M. Sonje, L. Kumar, V. Puri, G. Kohli, A. M. Kaushal, A. K. Bansal: Effect of counterions on the properties of amorphous atorvastatin salts. In: Eur J Pharm Sci. 44 (2011) S. 462–470, doi:10.1016/j.ejps.2011.08.023.
- ↑ a b Datenblatt Atorvastatin calcium salt trihydrate, ≥98% (HPLC) bei Sigma-Aldrich, abgerufen am 10. Februar 2013 (PDF).
- ↑ Eintrag zu Atorvastatin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Mai 2014.
- ↑ Ifap Arzneimittelnews: Basics GmbH bringt das erste generische Atorvastatin-Präparat auf den Markt (Memento vom 7. Juli 2012 im Webarchiv archive.today), abgerufen am 2. März 2012.
- ↑ Richard Daikeler, Götz Use, Sylke Waibel: Diabetes. Evidenzbasierte Diagnosik und Therapie. 10. Auflage. Kitteltaschenbuch, Sinsheim 2015, ISBN 978-3-00-050903-2, S. 149.
- ↑ P. Jones et al.: Comparative dose efficacy study of atorvastatin versus simvastatin, pravastatin, lovastatin, and fluvastatin in patients with hypercholesterolemia (the CURVES study). Am J Cardiol. 1. März 1998; 81 (5): S. 582–587; PMID 9514454.
- ↑ Anton F. H. Stalenhoef et al.: A Comparative study with rosuvastatin in subjects with Metabolic Syndrome: results of the COMETS study Eur Heart J. Dezember 2005;26 (24): S. 2664–2672 Volltext (HTML) Volltext (PDF; 264 kB), PMID 16143705.
- ↑ MedLine Plus Arzneimittelinformation (engl.).
- ↑ HMGCoA reductase inhibitor (statin) drugs- Risk of immune-mediated necrotizing myopathy (IMNM) Label Changes (englisch) U.S. Food and Drug Administration. 1. Oktober 2012. Archiviert vom Original am 3. März 2016. Abgerufen am 3. Mai 2021.
- ↑ N. Sattar et al.: Statins and risk of incident diabetes: a collaborative meta-analysis of randomised statin trials. In: The Lancet. Band 375, Nr. 9716, 2010, S. 735–742, doi:10.1016/S0140-6736(09)61965-6.
- ↑ B. Calo-Fernández, J. L. Martínez-Hurtado: Biosimilars: Company Strategies to Capture Value from the Biologics Market. Pharmaceuticals, Bd. 5, Nr. 12, 2012, S. 1393–1408. doi:10.3390/ph5121393
- ↑ ROUNDUP: Branchenprimus Pfizer greift im Geschäft mit Generika an (Memento vom 4. Juni 2009 im Internet Archive), finanzen.net vom 19. März 2009.
- ↑ Fabian Weber, Gottfried Sedelmeier: 200 umsatzstarke Medikamente. In: Nachrichten aus der Chemie. Band 61, Nr. 5, Mai 2013, S. 528–529, doi:10.1002/nadc.201390162.
- ↑ B. Hibbeler: Statine: Marktanteil von Sortis sinkt. In: Deutsches Ärzteblatt 2005, 102 (12): A-792/B-668/C-624 (Online-Version).
- ↑ Law et al. BMJ 2003; 326: S. 1423.
- ↑ Rote Liste Online, Stand: August 2009.
- ↑ Arzneimittelkompendium der Schweiz, Stand: August 2009.
- ↑ AGES-PharmMed, Stand: August 2009.
