Autokatalyse
Autokatalyse (gr. αυτοκατάλυση, aftokatálissi: „die Selbstauflösung“) bezeichnet eine besondere Form der katalytischen chemischen Reaktion, bei der ein Endprodukt als Katalysator für die Reaktion wirkt. Durch die fortlaufende Bildung dieses Katalysators wird die Reaktion ständig beschleunigt, solange noch genügend Ausgangsstoffe zur Verfügung stehen. Es handelt sich dabei um eine positive Rückkopplung.[1]
Beispiel
Redoxreaktion von Oxalsäure und Permanganat:
Die entstehenden Mangan(II)-Ionen wirken als Katalysator für diese Reaktion, so dass die anfänglich zögernde Entfärbung des Permanganats immer schneller verläuft. Werden zum Reaktionsstart Mangan(II)-Ionen zur Verfügung gestellt, so verläuft die Reaktion bereits zu Beginn schnell.
Zeitgesetz
Autokatalysen sind Reaktionen zweiter Ordnung:
Das Ratengesetz lautet:
Diese Differentialgleichung (DGL) wird gelöst, indem wir einen Ausdruck für aus der Massenerhaltung herleiten und die als Variable ausdrücken:
Dies ergibt dann die DGL:
Welche sich wie folgt löst:
Analog ergibt sich für :
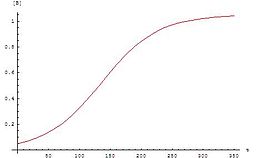
Der Graph für diese Gleichung folgt der für autokatalytische Reaktionen typischen Sigmoidfunktion: Die chemische Reaktion beginnt langsam, weil anfangs nur eine geringe Katalysatorkonzentration vorhanden ist. Die Geschwindigkeit der Reaktion erhöht sich ständig, da mit fortschreitender Reaktion die Konzentration des Katalysators steigt. Dann sinkt die Geschwindigkeit wieder, weil die Konzentrationen der Ausgangsstoffe abnehmen.
Chemische Oszillation
Die Anwesenheit von einem oder mehreren autokatalytischen Schritten kann zur chemischen Oszillation führen.
Siehe auch
Weblinks
Einzelnachweise
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 29, ISBN 978-3-906390-29-1.


![{\displaystyle \ v=-{\frac {d[A]}{dt}}=k[A][B]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/76198e9fc886c44bdf113b999dc651d8e9ba9330)
![{\displaystyle [B(t)]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a0f735b2013c0f281c7903e5a8bcf14760fafaf)
![{\displaystyle [A(t)]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5b8809671ceb2f0af46dea77ecb7166fac43e178)

![{\displaystyle [B(t)]=[A]_{0}+[B]_{0}-[A(t)]=[A]_{0}+[B]_{0}-x}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dc89fb9f31e9d67815b53a857f87e9d4cff14041)
![{\displaystyle {\frac {dx}{dt}}=-kx([A]_{0}+[B]_{0}-x)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/baca9de96afe892b2ddc1c0d5eff668cc94f2879)
![{\displaystyle \int {\frac {dx}{([A]_{0}+[B]_{0})x-x^{2}}}=\int -kdt}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1f9529b657ab4c3ff49313692fab78e2ffb81803)
![{\displaystyle {\frac {1}{[A]_{0}+[B]_{0}}}\cdot \ln \left({\frac {[A]_{0}[B(t)]}{[B]_{0}[A(t)]}}\right)=kt}](https://wikimedia.org/api/rest_v1/media/math/render/svg/784b912f03eba4c737d498a4a631e15f995d3838)
![{\displaystyle [B(t)]={\frac {[A]_{0}+[B]_{0}}{1+{\frac {[A]_{0}}{[B]_{0}}}\exp {\left(-([A]_{0}+[B]_{0})kt\right)}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/20139a60d876a7f949a47324e6f994debe3c38ac)
![{\displaystyle [A(t)]={\frac {[A]_{0}+[B]_{0}}{1+{\frac {[B]_{0}}{[A]_{0}}}\exp {\left(([A]_{0}+[B]_{0})kt\right)}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7eff587d896ea2bfde0521d9e84295e241251dfc)