Bariumphosphat
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
3 Bariumion 2 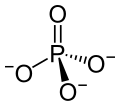
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Bariumphosphat | ||||||||||||
| Andere Namen |
Bariumorthophosphat | ||||||||||||
| Summenformel | Ba3(PO4)2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 601,9 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
4,1 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Bariumphosphat (genauer: Bariumorthophosphat) ist das Bariumsalz der Phosphorsäure.
Herstellung
Bariumorthophosphat kann aus Bariumhydrogenphosphat hergestellt werden, das zunächst durch Erhitzen auf 900 °C zu Bariumdiphosphat umgewandelt wird. Dieses reagiert mit Bariumcarbonat unter Abspaltung von Kohlendioxid zu Bariumorthophosphat.[2]
- Fehler beim Parsen (MathML mit SVG- oder PNG-Rückgriff (empfohlen für moderne Browser und Barrierefreiheitswerkzeuge): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle \mathrm{2\ BaHPO_4 \ \xrightarrow {900^{o}C} \ Ba_2P_2O_7 + H_2O \uparrow }}
- Fehler beim Parsen (MathML mit SVG- oder PNG-Rückgriff (empfohlen für moderne Browser und Barrierefreiheitswerkzeuge): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle \mathrm{Ba_2P_2O_7 + BaCO_3 \ \xrightarrow {1300^{o}C} \ Ba_3(PO_4)_2 + CO_2 \uparrow }}
Es entsteht auch bei der Reaktion von Natriumphosphat mit Bariumchlorid.[6][7]
- Fehler beim Parsen (MathML mit SVG- oder PNG-Rückgriff (empfohlen für moderne Browser und Barrierefreiheitswerkzeuge): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle \mathrm{3\ BaCl_2 + 2\ Na_3PO_4 \ \longrightarrow \ Ba_3(PO_4)_2 + 6\ NaCl }}
Ferner wurde die Reaktion von Dinatriumhydrogenphosphat mit Bariumchlorid in Gegenwart von Ammoniak beschrieben.[7][8]
Eigenschaften
Bariumorthophosphat existiert in zwei unterschiedlichen Kristallstrukturen. Der Phasenübergang findet bei 1360 °C statt.[2] Unter dem Umwandlungspunkt kristallisiert es im trigonalen Kristallsystem in der Raumgruppe R3m (Raumgruppen-Nr. 160) mit den Gitterparametern a = 7,696 Å und α = 42,58°. In der Elementarzelle befindet sich eine Formeleinheit.[9] Die Kristalle sind isomorph zu Strontiumphosphat.[9]
Verwendung
Bariumorthophosphat wird als Rohstoff zur Herstellung von Spezialglas[10] (z. B. Uviolglas) und als Trübungsmittel für Glas[11] verwendet.
Einzelnachweise
- ↑ Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. Springer, 1998, ISBN 978-3-540-60035-0, S. 328 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c E. Radominska, T. Znamierowska, W. Szuszkiewicz: Phase equilibria in the system Rb3PO4–Ba3(PO4)2. In: Journal of Thermal Analysis and Calorimetry 2011, 103(2). S. 761–766. doi:10.1007/s10973-010-0962-y
- ↑ Eintrag zu Bariumsalze in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag barium salts, with the exception of barium sulphate, salts of 1-azo-2-hydroxynaphthalenyl aryl sulphonic acid, and of salts specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Datenblatt Barium phosphate bei Sigma-Aldrich, abgerufen am 16. Februar 2020 (PDF).
- ↑ M. Berthelot: Recherches sur les phosphates. In: Compt. Rend. Hebd. 1886, 103, S. 911.
- ↑ a b R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie. Verlag S. Hirzel, Bd. 2, 1908. S. 282.
- ↑ C. Rammelsberg: Ueber die Zusammensetzung einiger phosphorsauren Salze. In: Pogg. Ann. 1846, 68, S. 383ff.
- ↑ a b W. H. Zachariasen: The Crystal Structure of the Normal Orthophosphates of Barium and Strontium. In: Acta Cryst. 1948, 1, S. 263–265. doi:10.1107/S0365110X48000697
- ↑ Landesamt Sachsen: Merkblatt Glas (Memento vom 14. Mai 2013 im Internet Archive)
- ↑ Eidgenössische Zollverwaltung: Kapitel 28: Anorganische chemische Erzeugnisse; anorganische oder organische Verbindungen von Edelmetallen, radioaktiven Elementen, Seltenerdmetallen oder Isotopen, abgerufen am 17. Juni 2017.

