Benutzer:Der Sebb/Trimethylstiban
aus Wikipedia, der freien Enzyklopädie
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
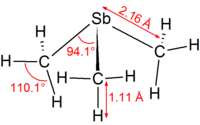
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Der Sebb/Trimethylstiban | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | (CH3)3Sb | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 166.86 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
80,6 °C[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Trimethylstiban ist eine metallorganische Antimonverbindung[3]
Darstellung
Trimethylstiban lässt sich aus Ammoniummethylpentafluorosilicat und Antimontrifluorid in wässriger Lösung darstellen.[2]
Zudem gibt es noch die Möglichkeit zur Herstellung aus Dimethylzink und Antimontrichlorid.[3]
Die Darstellung durch Hydrierung von Trimethylantimon(V)-bromid mit Lithiumborhydrid oder Lithiumaluminiumhydrid ist ebenfalls möglich.[5]
Eigenschaften
Trimethylstiban ist eine farblose, leicht oxidierbare, pyrophore[1] Flüssigkeit mit knoblauchartigem Geruch[2]. Sie löst sich gut in Alkohol sowie Ether und kaum in Wasser[3] und wird zudem zur Herstellung einer Vielzahl von Metallorganischen Verbindungen verwendet.[3][6]
Einzelnachweise
- ↑ a b c d Arnold F. Holleman, Nils Wiberg: Anorganishe Chemie. 103. Auflage. Band 1. DeGruyter, Berlin / Boston 2017, ISBN 978-3-11-026932-1, S. 982.
- ↑ a b c Richard Müller, Christian Dathe: Über Silikone, CVI. Darstellung von Organoantimon(III)- und Organobismutin(III)-Verbindungen mit Hilfe von Organopentafluorosilicaten bzw. Organotrifluorsilanen in wäßriger Lösung. In: Chemische Berichte. Band 99, Nr. 5, Mai 1966, S. 1609–1613, doi:10.1002/cber.19660990527 (wiley.com [abgerufen am 25. Februar 2021]).
- ↑ a b c d e f Hermann Kolbe: Ausführliches Lehrbuch der organischen Chemie : in drei Bänden : Bd. 3, Abth. 1 : / bearb. von E. von Meyer u. A. Weddige. In: Graham-Otto's ausführliches Lehrbuch der Chemie. 4. Auflage. Vieweg, Braunschweig 1878 (onb.ac.at).
- ↑ a b PubChem: Trimethylantimony. Abgerufen am 25. Februar 2021 (englisch).
- ↑ Egon Wiberg, Kurt Mödritzer: Notizen: Über die Hydrierung von Halogenverbindungen der 5. Hauptgruppe: II. Zur Frage der Existenz eines Antimon(V)-wasserstoffs SbH5. In: Zeitschrift für Naturforschung B. Band 11, Nr. 12, 1. Dezember 1956, ISSN 1865-7117, S. 748–750, doi:10.1515/znb-1956-1212 (degruyter.com [abgerufen am 26. Februar 2021]).
- ↑ Christoph Elschenbroich: Organometallchemie. 6., überarb. Auflage. Wiesbaden 2008, ISBN 978-3-8351-0167-8, S. 207–208.




![{\displaystyle {\ce {3 (NH4)2[CH3SiF5] + SbF3 -> (CH3)3Sb + 3 (NH4)2SiF6}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/966c6785eb7b115f73b32449a817536ab3b2d3e3)










