Benutzer:Martin-rnr/Walkadaver (Ökosystem)
Der Kelpwald ist ein marines Ökosystem, das hautpsächlich in gemäßigten Gewässern bis in etwa 20-30 m Tiefe vorkommt. Namensgebend ist der Kelp, eine Reihe großwüchsiger Braunalgen. Sie sind im Kelpwald das strukturgebende Element sowie hauptsächliche Primärproduzenten. Das pflanzliche Material des Kelp schafft die Grundlage für ein komplexes Nahrungsnetz, dass eine große Vielfalt von Wirbellosen und Fischen ernährt. An der Spitze des Nahrungsnetzes stehen räuberische Fische, Meeresvögel wie Kormorane und Meeressäuger wie Robben.
Aufbau und Lebenszyklus von Kelp
Hauptartikel: Laminariales
Als Kelp bezeichnet man Braunalgen aus der Ordnung Laminariales. Das auffälligste Stadium im Lebenszyklus von Kelp ist der Sporophyt - er besteht aus einem wurzelartigen Rhizoid (holdfast), dem sprossachsenartigen Cauloid (stipe) und dem blätterartigen Phylloid (blade), in dem die Photosynthese stattfindet. Ein solches Individuum bezeichent man bei Algen als Thallus. Große Arten wie aus der Gattung Macrocystis erreichen als Sporophyt Längen von bis zu 40 m.[1]
Sporophyten haben einen diploiden Chromosomensatz. Sie produzieren in einem Sporangium mittels Meiose haploide, mikroskopisch kleine Sporen. Diese siedeln sich am Meeresboden an und bilden kleine, männliche oder weibliche Gametophyten. Diese produzieren ihrerseits Antheridien und Oogonien, die wieder zu einer diploiden Zygote verschmelzen. Aus dieser kann sich ein Sporophyt entwickeln. Sporophyten können sehr schnell wachsen, Macrocystis-Sporophyten etwa können unter günstigen Bedingungen 50 cm pro Tag wachsen.[2]
Vorkommen und Standortfaktoren
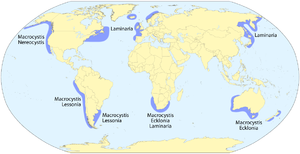
Kelpwälder kommen nahezu weltweit vor - momentan sind sie vor allem aus gemäßigten Meeren bekannt, möglicherweise wird jedoch die Häufigkeit in tropischen Gewässern unterschätzt. Die jeweils nördlichste und südlichste Grenze der Vebreitung markiert der 60. Breitengrad. Ab dem 40. Breitengrad zum Äquator hin werden Kelpwälder nach bisherigen Erkenntnissen nach und nach von anderen Braunalgen wie z.B. Golftangen (Sargassum) verdrängt. Die geografischen Regionen zeichnen sich jeweils durch eine individuelle Zusammensetzung verschiedener Laminariales-Arten aus. Die größte Diversität von Kelp weißen Kelpwälder vor Kalifornien mit 20 Arten auf. Ebenso können von ein und demselben Kelp dominierte Wälder regional unterschiedlich sein, da sich Kelp verschiedenen Parametern wie Wellenstärke und Wassertemperatur morphologisch anpasst.[3]
Ein wichtiger Faktor für das Vorkommen von Kelpwäldern sind ausreichende Menge Licht für die Photosynthese. Eng im Zusammenhang steht damit also, das Kelpwälder praktisch ausschließlich auf hartem Substrat wachsen, welches das Wasser weniger trübt und dem Kelp besseren Halt bietet. Sedimentation ist insbesondere für Sporen, Gametophyten und kleine Sporophyten schädlich. Licht begrenzt wahrscheinlich die Verbreitung nach Norden und Süden, da die langen Nächte des Polarwinters über große Zeiträume die Photosynthese verhindern.[4]
Damit sich Kelpwälder bilden können, müssen hohe Konzentrationen von Nährstoffen im Wasser gelöst sein, insbesondere Stickstoff in Form von Nitraten. Im Zusammenhang damit stehen die Strömungen, die bei Nichtvorhandensein zum Abfall von Nährstoffen führen. Kelpwälder finden sich also üblicherweise im Einzugsbereich nährstoffreicher Strömungen. Die meisten Kelparten sind flexibel bezüglich Salinität, nach einer Studie vor Chile benötigt aber zumindest Macrocystis integrifolia erhöhte Salinität zur Fortpflanzung.[5]
Kelp bevorzugt niedrige Temperaturen, und Kelpwälder finden sich vornehmlich in Meeresgewässern von weniger als 20°C Oberflächentemperatur. Dies hängt auch mit dem für Kelp essentiellen hohen Nährstoffgehalt zusammen, den kaltes Wasser im Vergleich zu warmen Wasser aufweist. Die richtige Lichtintensität liegt in solchen kalten Gewässern abseits der tropischen Meere bis in 20 m tiefem Wasser vor, in sehr klarem Wasser kann Kelpwald auch in 30 m Tiefe reichen. Da tropische Meere zu warm und der Nährstoffgehalt in für Kelp normalen Tiefen zu gering sind, wurden Kelpwälder um den Äquator für lange Zeit ausgeschlossen. Nach neueren Untersuchungen (Graham et al 2007) kann jedoch durch Auftrieb (upwelling) von nährstoffreichem, kalten Tiefenwasser ein für Kelp geeignetes Milieu in 30-200 m Tiefe geschaffen werden - die Klarheit und die Lichtintensität tropischer Meere ermöglicht dann trotz dieser Tiefe ein geeignetes Zusammenfallen von Nährstoffen und Licht. Bestätigt wurden tropische Kelpwälder erstmals vor Galápagos. Damit vergleichbar ist das Vorkommen von Kelpwäldern auf von upwelling geprägten Seebergen in 60-70 m Tiefe.[6]
Kelpwälder als Ökosysteme

Die Kelp-Algen lassen sich in vielen Kelpwäldern in drei grundlegende Gruppen einteilen, die eine Art Schichtbau wie im Wald an Land realisieren. Am größten sind die "Baumkronen"-Kelparten (canopy), die je nach Art 10-45 m hoch werden können. Ihre an der Wasseroberfläche treibenden Phylloide bilden das "Dach" des Kelpwaldes, dafür bilden sie gasgefüllte Blasen an ihren Cauloiden aus. Daneben existieren die üblicherweise unter 5 m langen, selten bis zu 10 m langen stipitate-Kelparten, die sich mit einem versteiften Cauloid aufrecht halten. Den untersten Teil des Kelpwald-Schichtbaus bilden verschiedene Algen, die sich am Boden ausbreiten. Kelp steht in einer Dichte von 0,01-01 Thallus/m².[7]
Kelpwald ist ein sehr produktives Ökosystem, ein Quadratmeter Laminaria-Wald etwa fixiert jährlich bis zu 1,9 kg Kohlenstoff. Der Kelp selber bietet Substrat für "epiphytische" Algen, und stellt die Grundlage eines komplexen Nahrungsnetzes aus 10 Stämmen von Tieren dar: Chordatiere, Gliederfüßer, Ringelwürmer, Stachelhäuter, Moostierchen, Nesseltiere, Weichtiere, Plattwürmer, Armfüßer und Schwämme. Kelpwälder mildern die Strömungen, dämpfen Licht und beeinflussen damit interspezifische Konkurrenz von Algen, und bieten einen dreidimensionalen strukturierten Lebensraum sowie Verstecke.[8]
Kelp bildet als Produzent zusammen mit Plankton die Grundlage für das Kelpwald-Nahrungsnetz. Allerdings werden kaum mehr als 10% der von Kelp erzeugten Biomasse durch Weidegang gefressen, von Kelp erzeugter Detritus hingegen ist eine weit wichtigere Nahrungsquelle für die Filtrierer des Kelpwalds. Filtrierer kommen im Kelpwald sehr artenreich vor, unter anderem Manteltiere, Schwämme, Anemonen, Moostierchen, Muscheln, Ringelwümrmer, Stachelhäuter, Krebstiere und einige Fische. Direkt den Kelp abgrasende Arten variieren je nach Größe des Kelp. Sporen, Gametophyten und sehr junge Sporopyhten sind Nahrung für die Meiofauna, Detritusfresser, Filtrierer wie Muscheln, und auch Käferschnecken, Seegurken und Seesterne. Mit dem Sporphyt wachsen auch die Fressfeinde, die alten Fressfeinde werden durch Vielborster, Schnecken, Krebstiere, einige Fische und Seeigel ersetzt. Fische grasen meist nur isolierten Kelp ab. Daneben existieren Arten, die den Algenwuchs auf Kelp abweiden; diese ökologische Nische nehmen unter anderem kleine Krebstiere ein.[9]
Diese Konsumenten erster Ordnung werden von einer Vielzahl von Prädatoren gefressen, zum Beispiel von Fischen wie den Klippfischen (Clinidae), die auf Flohkrebse Jagd machen. Andere Beispiele sind Neuschnecken, Seesterne und Kopffüßer. An der Spitze der Nahrungskette stehen unter anderem große Raubfische, Meeresvögel wie Kormorane und Meeressäuger wie Robben.[10]
Ebenfalls könnte Kelp eine vor Strömungen und Fressfeinden geschützte Entwicklungsstätte für die Larvenstadien von Zooplankton darstellen. Hinweise hierauf gibt eine Studie in den Gewässern vor den Prinz-Edward-Inseln, wo sich im Vergleich zum offenen Wasser überdurchschnittlich viele Larven von Ruderfußkrebsen im Kelpwald fanden.[11]
Dynamik
Die verschiedenen Kelparten befinden sich in Konkurrenz um Licht - in dieser Hinsicht sind canopy-Kelpe anderen Arten überlegen. Sie verhindern auch das Wachstum neuer Sporophyten, da sie diese vom Licht abschneiden. Die weniger großen Kelpe wie stipitate hingegen sind besser gegen Stürme etc. gewappnet. Während canopy-Kelp in einem störungsfreien Kelpwald Überhand nehmen würde, können sich nach Entfernung des Walddaches wie etwa durch Stürme die Gametophyten und Sporophyten von kleineren Kelp-Arten etablieren. Ebenso ermöglicht ein gelichter Kelpwald das verstärkte Wachstum anderer Algen, die sonst in der Konkurrenz um Licht unterlegen sind.[12]
Wachstum und Stoffwechselvorgänge des Kelp variieren mit der Jahreszeit. Kelp wächst meist im Winter und Frühling besonders stark - beim Mohawk Forest vor Kalifornien verdoppeln sich im Winter Fläche und Dichte des Kelps. Im Sommer wird die Wassersäule durch hohe Temperaturen und Abnahme der Strömungen geschichtet - es fehlt also der Nährstoffnachschub (insbesondere Nitrate) aus kaltem Tiefenwasser, zumal durch das Fehlen von Stürmen keine vertikale Durchmischung erfolgt. Es setzt also, untersützt durch Herbststürme, eine hohe Mortalität von Kelp ein. Dem wirkt Kelp im gewissen Maße entgegen, indem im Winter und Frühling Stickstoffreserven angelegt werden.[13]
Der wichtigste Fressfeind des Kelps sind Seeigel. Besonders gut erforscht ist der Seeigel Strongylocentrotus purpuratus in Kalifornien, es existiert jedoch in praktisch allen Kelpwäldern mindestens eine kelpfressende Art der Seeigel. Normalerweise leben Seeigel von Detritus des Kelps, gelegentlich löschen sie jedoch große Flächen Kelpwald aus und halten sie über Jahre hinweg kahl (urchin barren). Oft ist dies nach heftigen Stürmen wie El Niño der Fall: Da dann der Kelp auf großen Flächen ausgelöscht wurde, müssen die Seeigel Gametophyten und junge Sporophyten abweiden, womit sie eine Wiederansiedlung von Kelp verhindern. Nach Bestandseinbrüchen der Seeigel etwa durch Krankheiten kann Kelp sich wieder etablieren. Auch wenn ungünstige Strömungen Algen verdriften, verlieren Seeigel eine ihrer Nahrungsquellen und überweiden Kelp. Gelegentlich können auch günstige Strömungen besonders viele Larven der Seeigel zur Absiedlung bringen, was dann zu Überweidung führt. Die Bestände der Seeigel werden meistens durch Fressfeinde kontrolliert, im NO-Pazifik etwa vom Seeotter (Enhydra lutris). Daher wurden das Kelpwald-Ökosystem empfindlich gestört, als die Seeotter für den Pelzhandel nahezu ausgerottet wurden.[14]
Kelpwälder stellen einen Widerstand gegen Meeresströmungen dar, wodurch die räumliche Verfügbarkeit von Nährstoffen beeinflusst wird. Im Inneren von Kelpwäldern sind die Strömungen Strömungen schwächer als außerhalb. In großen Kelpwäldern kann dies dazu führen, dass nicht ausreichende Mengen von Nährstoffen in den mittleren Kelpwald gelangen. In Folge wird der Kelp in seinem Wachstums eingeschränkt. Die räumliche Variabilität von Strömungen hat Einfluss auf Nahrungserwerb und Fortpflanzung seiner Bewohner. Dies lässt sich am Rand von Kelpwälden beobachten: Durch das Abfangen von Meeresströmungen entsteht dort eine hohe Konzentration von Nährstoffen und Plankton, in welcher filtrierende Fischen bevorzugt Nahrung aufnehmen.[15]
Wirtschaftliche Nutzung
Kelpwälder dienen dem Menschen seit Jahrtausenden als Fischgründe, auch der Kelp selber wurde als Nahrung genutzt. In einigen Teilen der Welt werden Kelpwälder heute noch befischt, und Kelp zum Verzehr oder zur Produktion von Alginsäure abgeerntet. Örtlich wird Kelp in Aquakulturen angebaut.[16]
Gefährdung
Literatur und Belege
|
|
|
Notizen
- http://www.springerlink.com/content/m7l6786kgr483k7w/
- http://bio.classes.ucsc.edu/bio161/Papers/Reed%20and%20Foster%201984.pdf
- http://www.sonoma.edu/users/n/nielseka/pubications/kavanaugh_etal_2009_l-o_54.pdf
- http://www.indiaenvironmentportal.org.in/files/carbon_managment_report_final_printed_version_1.pdf#page=41
- http://escholarship.org/uc/item/7q7948fg
- http://www.pnas.org/content/99/6/3678.full.pdf
- http://ucsb.piscoweb.org/~broitman/PUBS/halpern_cottenie_broitman06.pdf
- http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6T8F-48882NJ-1M&_user=10&_coverDate=08%2F22%2F1989&_rdoc=1&_fmt=high&_orig=gateway&_origin=gateway&_sort=d&_docanchor=&view=c&_searchStrId=1733937425&_rerunOrigin=scholar.google&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=805f2434dd6999786eddcf80338ec7d8&searchtype=a
- http://digitalcommons.calpoly.edu/cgi/viewcontent.cgi?article=1280&context=bio_fac
- http://gradworks.umi.com/33/30/3330405.html
- http://onlinelibrary.wiley.com/doi/10.1111/j.1461-0248.2005.00731.x/abstract
- http://www.esajournals.org/doi/abs/10.1890/08-1213.1?journalCode=ecol
[[Datei:Whale fall.jpg|thumb|Grauwal (''Eschrichtius robustus''), 35 t, 13 m, 1700 m Tiefe, 18 Monate.]] == Ökologie == * '''''Mobile scavenger stage''''' ("Mobile-Aasfresser-Phase"): Nachdem der Wal auf den Meeresgrund gelangt, beginnen mobile Aasfresser mit dem Abbau von Weichgewebe. Schleimaale, Haie und Krebstiere<ref name="smithbaco2003p318"/> verzehren täglich etwa 40-60 kg vom Fleisch des Wals. Diese Rate steigt mit der Größe des Wals, von sehr kleinen Kadavern sind hingegen nur Raten von 1-4 kg pro Tag bekannt. Bei den meisten Kadavern neigt sich diese Phase nach spätestens 2 Jahren dem Ende zu, bei sehr großen Kadaver (100 t) endet diese Phase wohl erst nach 5 Jahren.<ref name="smithbaco2003p319"/> Schleimaale werden aus mindestens 0,6-0,8 km Entfernung von einem frisch gesunkenen Walkadaver angezogen.<ref name="smithbaco2003p318"/> * '''''Enrichment-opportunist stage''''' ("Anreicherungs-Opportunisten-Phase"): * '''''Sulfophilic stage''''' ("Sulfophile Phase"): * '''''Reef stage''''' ("Riff-Phase"): == Literatur == * C. R. Smith (2007): ''Bigger Is Better: The Role of Whales as Detritus in Marine Ecosystems''. In: J. A. Estes, D. P. DeMaster, D. F. Doak, T. M. Williams & R. L. Brownell (Hrsg.): ''Whales, Whaling, and Ocean Ecosystems'': 286-300. University Press of California, Berkeley. ISBN 9780520248847 * C. R. Smith & A. R. Baco (2003): ''Ecology of whale falls at the deep-sea floor''. Oceanography and Marine Biology: an Annual Review (41): 311–354 * Y. Fujiwara, M. Kawato, T. Yamamoto, T. Yamanaka, W. Sato-Okoshi, C. Noda, S. Tsuchida, T. Komai, S. S. Cubelio, T. Sasaki, K. Jacobsen, K. Kubokawa, K. Fujikura, T. Maruyama, Y. Furushima, K. Okoshi, H. Miyake, M. Miyazaki, Y. Nogi, A. Yatabe & T. Okutani (2007): ''Three-year investigations into sperm whale-fall ecosystems in Japan''. Marine Ecology 28(1): 219–232 * T. Treude, C. R. Smith, F. Wenzhöfer, E. Carney, A. F. Bernardino, A. K. Hannides, M. Kriger & A. Boetius (2009): ''Biogeochemistry of a deep-sea whale fall: sulfate reduction, sulfide efflux and methanogenesis''. Marine Ecology Progress Series 382: 1–21 == Belege == <references> <ref name="smithbaco2003p318">Smith & Baco (2003): 318</ref> <ref name="smithbaco2003p319">Smith & Baco (2003): 319</ref> </references><references/>