Benutzer:Moriac87/Spielwiese/Wharton-Olfeinsynthese
Die Wharton-Olfeinsynthese ist eine Namensreaktion aus dem Bereich der organischen Chemie und wurde 1961 von Peter S. Wharton beobachtet. Dabei findet eine Reduktion von α,β-Epoxyketonen zu Allylalkoholen statt.[1]
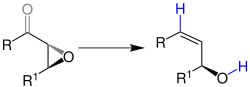
Übersichtsreaktion
Die Wharton-Olfeinsynthese wird in essigsaurer Umgebung mit Hydrazin (NH2NH2) ausgeführt.
Die grau eingezeichneten Bindungen trennen sich bei der Reaktion und die blau eingezeichnete Bindungen werden dabei neu geknüpft. Die Reste R und R1 stehen für organische Reste. Der neugeformte Alkohol behält bei der Reaktion seine Konfiguration und die Doppelbindung ist primär in der trans-Konfiguration vorzufinden.
Möglicher Mechanismus
Der folgende Mechanimsus der Wharton-Olfeinsynthese wird anhand eines α,β-Epoxyketons im Ring erklärt.[1]
Das α,β-Epoxyketon (1) wird durch das Hydrazin protoniert und gleichzeitig greift das Hydrazin in ipso-Position der Hydroxid-Gruppe an und bildet das Zwischenprodukt 2. Durch die Kondensation der Hydroxi-Gruppe und dem Hydrazin entsteht das Hydrazon 3. Das Hydrazon wird von der Essigsäure an der Amingruppe protoniert und es entsteht das Intermediat 4, welches durch interne Umlagerung des Protons erst den Epoxidring öffnet 5 und dann wieder vom Acetat-Ion (AcO-) deprotoniert wird 6. Zuletzt findet ein Abbau der Diazoverbindung statt ,sodass elementarer Stickstoff und trans-6-Methylcyclohex-2-en-1-ol (7) als Endprodukt entsteht.
Anwendung
Obwohl als Nebenprodukte nur Wasser und Stickstoff als Gas entstehen, ist die Wharton-Olefinsynthese bis heute in der organischen Chemie nicht verbreitet.
Literatur
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. First Edition, John Wiley & Sons, Ney Jersey 2009, S.2994-2997, ISBN 978-0-471-70450-8.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis, Elsevier Academic Press, 2005, S.482, ISBN 978-0-12-429785-2.