Caesiumaurid
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| _ Cs+ _ Au− | ||||||||||
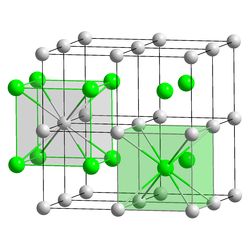
| Kristallsystem |
kubisch | |||||||||
| Raumgruppe |
Pm3m (Nr. 221) | |||||||||
| Allgemeines | ||||||||||
| Name | Caesiumaurid | |||||||||
| Verhältnisformel | CsAu | |||||||||
| Kurzbeschreibung |
gelbe bis rote Kristalle[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 329,87 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
7,065 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Caesiumaurid (CsAu) ist eine ionische Verbindung, die das ungewöhnliche Au− -Ion enthält. Sie wurde 1978 im Labor Joseph Lagowski[3] entdeckt.
Die Verbindung bildet sich beim Erhitzen einer stöchiometrischen Mischung aus Caesium und Gold; die beiden gelben Metalle ergeben ein klares Produkt. Die Lösung in flüssigem Ammoniak ist braun, während der Feststoff gelb aussieht; das Ammoniakaddukt ist dunkelblau. Obwohl die Verbindung aus zwei Metallen gebildet wird, hat sie keine metallischen Eigenschaften[4][5] und ist stattdessen ionisch aufgebaut. Aus polaren Lösungsmitteln kann das Gold an der Anode abgeschieden werden.
Die Verbindung reagiert heftig mit Wasser unter Bildung von Caesiumhydroxid, metallischem Gold und Wasserstoff. In flüssigem Ammoniak kann das Caesiumion durch Ionentauscher gegen das Tetramethylammonium-Ion ausgetauscht werden.[6]
Einzelnachweise
- ↑ a b c
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ W.J. Peer and J.J. Lagowski (1978), Metal-Ammonia Solutions. 11. Au−, a Solvated Transition Metal Anion In: J. Am. Chem. Soc. 100, 6260–6261.
- ↑ B. Busse, K. Weil: Existenz und Bindungsenergie des Caesiumaurid-Moleküls. In: Angewandte Chemie, (1979), Modul:Vorlage:Handle * library URIutil invalid
- ↑ James E. Huheey, Ellen A. Keiter, Richard L. Keiter: Anorganische Chemie: Prinzipien von Struktur und Reaktivität, 4. Auflage, Walter de Gruyter 2012, S. 599f
- ↑ Martin Jansen: Effects of relativistic motion of electrons on the chemistry of gold and platinum. In: Solid State Sciences. 7, Nr. 12, 30. November 2005, S. 1464–1474. Modul:Vorlage:Handle * library URIutil invalid.