Caesiumperoxid
| Kristallstruktur | |||
|---|---|---|---|
| |||
| _ Cs _ O | |||
| Allgemeines | |||
| Name | Caesiumperoxid | ||
| Andere Namen |
| ||
| Verhältnisformel | Cs2O2 | ||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||
| Externe Identifikatoren/Datenbanken | |||
| |||
| Eigenschaften | |||
| Molare Masse | 297,8 g·mol−1 | ||
| Aggregatzustand |
fest[1] | ||
| Dichte |
4,74 g·cm−3[1] | ||
| Schmelzpunkt | |||
| Sicherheitshinweise | |||
| |||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||
Caesiumperoxid ist eine anorganische chemische Verbindung des Caesiums aus der Gruppe der Peroxide.
Gewinnung und Darstellung
Caesiumperoxid kann durch schnelle Oxidation mit Sauerstoff von in flüssigem Ammoniak gelösten Caesium bei −50 °C gewonnen werden.[1]
Sie kann auch durch thermische Zersetzung von Caesiumsuperoxid gewonnen werden.[2]
Eigenschaften
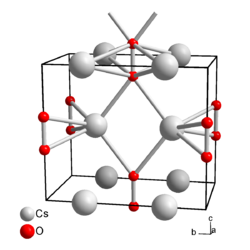
Caesiumperoxid ist ein in reinster Form farbloser, sonst gelber, feuchtigkeitsempfindlicher, sehr harter Feststoff, der mit Wasser unter Bildung von Wasserstoffperoxid und Caesiumhydroxid reagiert. Mit Wasserstoffperoxid reagiert er zum Tetrahydrat. Bei Erhitzung zersetzt sich Caesiumperoxid zu Caesiumoxid und Sauerstoff. Er besitzt eine orthorhombische Kristallstruktur der Raumgruppe Immm (Raumgruppen-Nr. 71), a = 432,2 pm, b = 751,7 pm, c = 643,0 pm.[1][2][4] In der Kristallstruktur wird jedes Caesiumion von vier Peroxidionen koordiniert, jedes Peroxidion hat Bindungen zu acht Caesiumionen.
Verwendung
Caesiumperoxid ist die aktive Komponente in Silber-Sauerstoff-Caesium AgOCs Photokathoden.[2]
Einzelnachweise
- ↑ a b c d e Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 955.
- ↑ a b c d Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 0-412-30120-2, S. 3097 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ R.W.G. Wyckoff, Crystal Structures, 1, 85-237 (1963), Second edition. Interscience Publishers, New York.
