Calciumperchlorat
aus Wikipedia, der freien Enzyklopädie
| Strukturformel | ||||||||
|---|---|---|---|---|---|---|---|---|
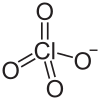
| ||||||||
| Allgemeines | ||||||||
| Name | Calciumperchlorat | |||||||
| Andere Namen |
Kalziumperchlorat | |||||||
| Summenformel | Ca(ClO4)2 | |||||||
| Kurzbeschreibung | ||||||||
| Externe Identifikatoren/Datenbanken | ||||||||
| ||||||||
| Eigenschaften | ||||||||
| Molare Masse | 238,98 g·mol−1 | |||||||
| Aggregatzustand |
fest[1] | |||||||
| Dichte |
2,651 g·cm−3[1] | |||||||
| Schmelzpunkt | ||||||||
| Löslichkeit |
leicht in Wasser (1886,0 g·l−1 bei 25 °C)[3], Ethanol und Methanol[4] | |||||||
| Sicherheitshinweise | ||||||||
| ||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||
Calciumperchlorat ist eine chemische Verbindung aus der Gruppe der Calciumverbindungen und Perchlorate.
Vorkommen
Calciumperchlorat wurde neben Wasser durch den Mars-Rover Curiosity im Marsboden entdeckt.[5]
Gewinnung und Darstellung
Calciumperchlorat kann durch Reaktion von Calciumcarbonat mit Ammoniumperchlorat gewonnen werden.
Eigenschaften
Calciumperchlorat ist ein sehr reaktionsfähiger brandfördernder Feststoff, welcher leicht löslich in Wasser ist.[1]
Verwendung
Calciumperchlorat wird in Leuchtfackeln verwendet.[6]
Einzelnachweise
- ↑ a b c d e f g Eintrag zu Calciumperchlorat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ Datenblatt Calcium perchlorate (PDF) bei Strem, abgerufen am 25. Dezember 2012.
- ↑ Helmut Vogt, Jan Balej, John E. Bennett, Peter Wintzer, Saeed Akbar Sheikh, Patrizio Gallone, Subramanyan Vasudevan, Kalle Pelin: Chlorine Oxides and Chlorine Oxygen Acids. In: Ullmann's Encyclopedia of Industrial Chemistry. 2000, doi:10.1002/14356007.a06_483.pub2.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. CRC Press, 2009, ISBN 978-1-4200-9084-0.
- ↑ heise online: Curiosity findet Hinweise auf flüssiges Wasser auf dem Mars, abgerufen am 13. April 2015.
- ↑ Earl L. Hagström, Brian Scott Aikin: Perchlorate: a scientific, legal, and economic assessment. Lawyers and Judges Publishing, 2006, ISBN 978-1-930056-84-8, S. 6 (eingeschränkte Vorschau in der Google-Buchsuche).

