Calmodulin
| Calmodulin | ||
|---|---|---|
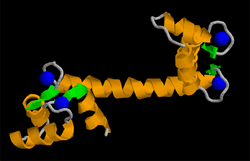
| ||
| nach PDB 1CLL. Ca2+: blau, alpha-Helices: orange, beta-Faltblätter: grün | ||
|
Vorhandene Strukturdaten: s. UniProt | ||
| Masse/Länge Primärstruktur | 148 Aminosäuren | |
| Kofaktor | 4 Calcium | |
| Bezeichner | ||
| Gen-Name(n) | CALM1, CALM2, CALM3 | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Calmodulin | |
| Übergeordnetes Taxon | Chordatiere | |
Calmodulin (CaM) ist ein Calcium bindendes regulatorisches Protein, welches in allen Eukaryoten hochkonserviert vorkommt. Calmodulin spielt als Second Messenger eine wichtige Rolle, indem es selbst nicht enzymatisch aktiv ist, sondern für die Aktivierung anderer Proteine verantwortlich ist. Es gehört zu der Gruppe der EF-Hand-Proteine. Als EF-Hand wird die Struktur der Calcium-bindenden Region bezeichnet, die eine typische Helix-Schleife-Helix-Struktur bildet. Diese Proteinfamilie, zu der u. a. Troponin C, Parvalbumin und Calbindin gehören, ist eine der zwei wichtigen Calcium-bindenden Proteinfamilien, hinzu kommt noch die Gruppe der Annexine. Calmodulin ist beim Menschen in der glatten Muskulatur an Aktin gebunden zu finden, wo es die Kontraktion reguliert. Zudem findet sich Calmodulin auch in menschlichen Geruchszellen der Nase, bei denen es nach Bindung von Ca2+ für eine Adaption an einen Geruchsstoff sorgt.[1]
Es sind drei Allele bekannt, die für das identische Protein kodieren.
Ziele des aktiven Ca2+/Calmodulin-Komplexes sind beispielsweise die CaM-abhängige Kinase (CaMK), die Adenylylcyclase, die Myosinleichtkettenkinase (MLCK), die Phosphatase Calcineurin und die Endotheliale Stickstoffmonoxid-Synthase (eNOS).
Einige Stoffe wie das W-7 hemmen das Protein als Calmodulin-Inhibitoren, indem sie das für Enzymaktivierungen notwendige Calcium aus der Zelle transportieren.
Weblinks
- Jennifer McDowall/Interpro: Protein Of The Month: Calmodulin. (engl.)
- SVU / Proteopedia: Calmodulin in motion
- SVU / vimeo: Calmodulin (molekulare Dynamik als Video)
Einzelnachweise
- ↑ U. Benjamin Kaupp, Reinhard Seifert: Cyclic nucleotide-gated ion channels. In: Physiological Reviews. Band 82, Nr. 3, Juli 2002, ISSN 0031-9333, S. 769–824, doi:10.1152/physrev.00008.2002, PMID 12087135.