Chlor(methyl)silan
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Chlor(methyl)silan | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | CH5ClSi | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 80,59 g·mol−1 | ||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||
| Dichte |
0,94 g·cm−3 (−80 °C)[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt | |||||||||||||
| Dampfdruck |
724 hPa bei 0 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
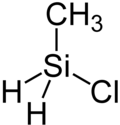
Chlor(methyl)silan ist eine chemische Verbindung aus der Stoffklasse der Silane. Sie besteht aus einem zentralen Siliciumatom, um welches tetraedrisch zwei Wasserstoffatome und jeweils ein Chloratom und ein Methylrest koordiniert sind.
Darstellung
Chlor(methyl)silan kann durch die Chlorierung von Methylsilan mit Chlorwasserstoff in Gegenwart von Aluminiumchlorid als Katalysator bei erhöhter Temperatur hergestellt werden.[1] Als Nebenprodukt entsteht Dichlor(methyl)silan.
Eigenschaften
Es handelt sich um eine bei Raumtemperatur gasförmige Verbindungen, die sich bei −46 °C (bei 13 hPa) verflüssigt und bei −135 bis −134 °C erstarrt.
Verwendung
Chlor(methyl)silan kann zur Herstellung von organischen Silanen dienen. Der Chlorsubstituent dient hierbei als Abgangsgruppe und kann in einer Substitutionsreaktion durch Nukleophile ausgetauscht werden. Als Nukleophile können beispielsweise Grignard-Verbindungen[4] oder Organolithium-Verbindungen[5] verwendet werden.
Quellen
- ↑ a b c d A. Stock, C. Somieski: Siliciumwasserstoffe VI.: Chlorierung und Methylierung des Monosilans, in: Chem. Ber. 1919, 52, 710; doi:10.1002/cber.19190520410.
- ↑ E. Hengge, W. Kalchauer: Neue Wege zu Polysilanen, in: Monatsh. Chem. 1990, 121, 793–802.
- ↑ a b Eintrag zu Methylchlorsilan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. Januar 2016. (JavaScript erforderlich)
- ↑ E. Lukevics, R. Sturkovich, Y. Goldberg, A. Gaukhman: Reactions of heteroarylhydrosilanes with dichlorocarbene under phase-transfer conditions, in: J. Organomet. Chem. 1988, 345, 19–25.
- ↑ E. Lukevics, V. Ryabova, P. Arsenyan, S. Belyakov, J. Popelis, O. Pudova: Bithienylsilanes: unexpected structure and reactivity, in: J. Organomet. Chem. 2000, 610, 8–15.



![{\displaystyle \mathrm {H_{3}SiCH_{3}+\ HCl{\xrightarrow[{AlCl_{3}}]{100\,{}^{\circ }C,24h}}\ H_{2}ClSiCH_{3}\ +\ H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e2f75898ed7627dbd39dd44eb514f489aa8fc519)