Cobalt(II)-thiocyanat
| Kristallstruktur | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| _ Co _ S _ C _ N | ||||||||
| Allgemeines | ||||||||
| Name | Cobalt(II)-thiocyanat | |||||||
| Andere Namen |
| |||||||
| Verhältnisformel | Co(SCN)2 | |||||||
| Kurzbeschreibung |
gelb-brauner Feststoff[1] | |||||||
| Externe Identifikatoren/Datenbanken | ||||||||
| ||||||||
| Eigenschaften | ||||||||
| Molare Masse | 175,10 g·mol−1 | |||||||
| Aggregatzustand |
fest[2] | |||||||
| Dichte |
1,786 g·cm−3 (Trihydrat)[3] | |||||||
| Löslichkeit | ||||||||
| Sicherheitshinweise | ||||||||
| ||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||
Cobalt(II)-thiocyanat ist eine anorganische chemische Verbindung des Cobalts aus der Gruppe der Thiocyanate.
Gewinnung und Darstellung
Cobalt(II)-thiocyanat kann durch Reaktion von Cobalt(II)-sulfat mit Bariumthiocyanat gewonnen werden.[3]
Ebenfalls möglich ist die Darstellung durch Reaktion von Thiocyansäure mit Cobalt(II)-carbonat[5] oder durch Reaktion von Ammoniumthiocyanat und Cobaltsalzen in neutraler Lösung.[6]
Eigenschaften
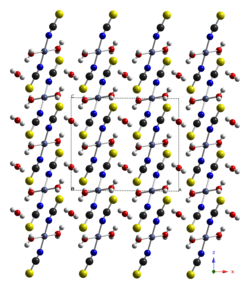
Cobalt(II)-thiocyanat ist ein gelb-brauner Feststoff, der in Wasser löslich ist. Die Lösung hat eine rötliche Farbe. Das Trihydrat hat eine violette bis braune Farbe, das im Durchlicht rot aussieht und sich in Wasser unter Blaufärbung löst. Es wandelt sich ab 105 °C in das Anhydrat um.[1] Das Trihydrat besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/c (Raumgruppen-Nr. 15).[3]
Verwendung
Cobalt(II)-thiocyanat kann zum Nachweis von Alkaloiden, Methadon, Ephedrin, Cocain und anderen Drogen verwendet werden. Wenn diese zu einer 2-prozentigen Lösung von Cobalt(II)-thiocyanat zugegeben werden, so bildet sich je nach Verbindung ein blauer oder blau-grüner Niederschlag. Dies wird (mit Zugabe von Chloroform[7]) als Scott-Test bezeichnet.[8] Das Trihydrat wird als Luftfeuchtigkeitsindikator verwendet.[1] Eine wässrige Lösung der Verbindung kann zur Bestimmung von nichtionischen Tensiden auf Basis von Ethoxylaten in Wasser verwendet werden.[9]
Einzelnachweise
- ↑ a b c d Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 131 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Datenblatt Cobalt(II) thiocyanat, 99.9% trace metals basis bei Sigma-Aldrich, abgerufen am 10. Dezember 2015 (PDF).
- ↑ a b c F. H. Cano, S. García-Blanco, A. G. Laverat: The crystal structure of cobalt(II) thiocyanate trihydrate. In: Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 32, S. 1526, doi:10.1107/S0567740876005694.
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, 2015, ISBN 978-1-4822-6097-7, S. 60 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Philipp Kurz, Norbert Stock: Synthetische Anorganische Chemie Grundkurs. Walter de Gruyter, 2013, ISBN 978-3-11-025875-2, S. 73 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Helmut Hofmann, Gerhart Jander: Qualitative Analyse. Walter de Gruyter, 1972, ISBN 978-3-11-003653-4, S. 123 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ David E. Newton: Forensic Chemistry. Infobase Publishing, 2007, ISBN 978-1-4381-0976-3, S. 86 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Rick Houghton: Field Confirmation Testing for Suspicious Substances. CRC Press, 2009, ISBN 978-1-4200-8616-4, S. 174 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Rolf Pohling: Chemische Reaktionen in der Wasseranalyse. Springer-Verlag, 2015, ISBN 978-3-642-36354-2, S. 344 (eingeschränkte Vorschau in der Google-Buchsuche).



