Cobalthydroxidoxid
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
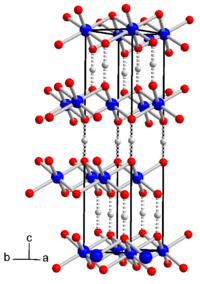
| Kristallstruktur von Cobalthydroxidoxid. Gestrichelte Linien: Wasserstoffbrückenbindungen. _ Co3+ _ O− _ H+ | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Cobalthydroxidoxid | ||||||||||||
| Andere Namen |
| ||||||||||||
| Verhältnisformel | CoO(OH) | ||||||||||||
| Kurzbeschreibung |
brauner Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 91,93 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
4,29–4,90 g·cm−3[1] | ||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Cobalthydroxidoxid ist eine anorganische chemische Verbindung aus der Gruppe der Hydroxide.
Gewinnung und Darstellung
Cobalthydroxidoxid kann durch Reaktion von Cobalt(II)-hydroxid mit Sauerstoff gewonnen werden.[1]
Eigenschaften
Cobalthydroxidoxid ist ein braunes Pulver. Bei über 150 °C wird die Verbindung in steigendem Maße unter Cobalt(II,III)-oxid-Bildung und gleichzeitiger Abgabe von Sauerstoff und Wasser zersetzt. Es ist in Salzsäure unter Chlor-Entwicklung löslich und schwer löslich in Salpetersäure und Schwefelsäure. Organische Säuren, wie Oxalsäure und Weinsäure, lösen es unter Reduktion. Alkalilaugen und Ammoniak greifen es nicht an. Die Verbindung hat eine trigonale Kristallstruktur mit der Raumgruppe R3m (Raumgruppen-Nr. 166) und den Gitterparametern a = 285,5 pm und c = 1315,7 pm).[1] Sie besteht aus Schichten von AlO6-Oktaedern, die durch Wasserstoffbrückenbindungen verbunden sind. Es ist auch eine hexagonale Form in der Raumgruppe P63/mmc (Nr. 194) bekannt.[4]
Einzelnachweise
- ↑ a b c d e Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1666.
- ↑
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ M. Deliens, H. Goethals: Polytypism of heterogenite. In: Mineralogical Magazine, 39, 1973, S. 152–157, PDF.
