Cytochrom b
| Cytochrom b | ||
|---|---|---|
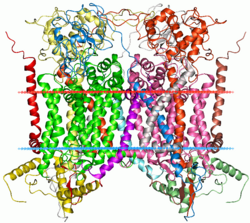
| ||
| Bändermodell des Cytochrom bc1 mit Cytochrom b als größter Untereinheit | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 380 Aminosäuren | |
| Kofaktor | Häm | |
| Bezeichner | ||
| Gen-Namen | MT-CYB (CYB_HUMAN) | |
| Externe IDs | ||
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen[1] | |
Cytochrom b bezeichnet eine Gruppe von Transmembranproteinen. Die Vertreter sind in Mitochondrien an der Atmungskette, in Chloroplasten an der Photosynthese oder im Steroidstoffwechsel beteiligt.
Eigenschaften
Cytochrom b kommt in Eukaryoten und aeroben Prokaryoten in zwei Proteinkomplexen vor, im Mitochondrium im Cytochrom bc1- (synonym Ubichinol-Cytochrom-c-Reduktase) und in Chloroplasten im Cytochrom b6f-Komplex.[2] Weiterhin kommt das Cytochrom b5 in Proteinen der Entgiftung und im Steroidstoffwechsel vor, wo es Redoxreaktionen katalysiert.[3]
Cytochrom b ist in der Atmungskette Bestandteil des Komplex III und dient dem Aufbau der protonenmotorischen Kraft, die dann zur Synthese von Adenosintriphosphat an der ATP-Synthase verwendet wird. Nebenbei wird am Komplex III auch Superoxid gebildet, welches zum oxidativen Stress in einer Zelle beiträgt.[4]
Cytochrom b und b6 sind strukturell verwandt.[5][6] Cytochrom b/b6 besitzt eine Länge von ungefähr 400 Aminosäuren und 8 Durchgänge der Membran. Das Cytochrom b6 (in Chloroplasten) besteht aus zwei Untereinheiten, petB und petD. Cytochrom b und b6 binden jeweils zwei Häm-Gruppen (b562 und b566) als Cofaktor. Vier Eisenionen werden von Histidinen in der Nähe des Häms gebunden und so am Häm stabilisiert.
Beim Menschen wurden verschiedene Gene für Cytochrom b beschrieben, darunter CYB5A in Mikrosomen, CYB5B in der äußeren mitochondrialen Membran, CYBASC3 (Ascorbinsäure-abhängig) und MT-CYB (von Mitochondrien codiert). Gendefekte in Cytochrom-b-Genen führen unter anderem zu Leberscher Optikusatrophie (LHON), zum Kearns-Sayre-Syndrom, zum MELAS-Syndrom, zu maternal-vererbtem Leigh-Syndrom, zu Trainingsintoleranz oder Cardiomyopathie.[7] Nichtpathologische Genvarianten wurden beschrieben.[7]
Anwendungen
Cytochrom b ist ein relativ stark konserviertes Protein, weshalb im Zuge einer DNA-Analyse die Gene von Cytochrom-b zur Bestimmung der Verwandtschaftsgrade verschiedener Arten verwendet wird.[8][9]
Einzelnachweise
- ↑ Homologiegruppe bei OMA
- ↑ M. A. Schöttler, S. Z. Tóth, A. Boulouis, S. Kahlau: Photosynthetic complex stoichiometry dynamics in higher plants: biogenesis, function, and turnover of ATP synthase and the cytochrome b 6 f complex. In: Journal of experimental botany. Band 66, Nummer 9, Mai 2015, S. 2373–2400, doi:10.1093/jxb/eru495, PMID 25540437.
- ↑ K. H. Storbeck, A. C. Swart, C. L. Fox, P. Swart: Cytochrome b5 modulates multiple reactions in steroidogenesis by diverse mechanisms. In: The Journal of steroid biochemistry and molecular biology. Band 151, Juli 2015, S. 66–73, doi:10.1016/j.jsbmb.2014.11.024, PMID 25446886.
- ↑ P. Lanciano, B. Khalfaoui-Hassani, N. Selamoglu, A. Ghelli, M. Rugolo, F. Daldal: Molecular mechanisms of superoxide production by complex III: a bacterial versus human mitochondrial comparative case study. In: Biochimica et Biophysica Acta. Band 1827, Nummer 11–12, 2013 Nov-Dec, S. 1332–1339, doi:10.1016/j.bbabio.2013.03.009, PMID 23542447, PMC 3740082 (freier Volltext).
- ↑ C. Breyton: The cytochrome b(6)f complex: structural studies and comparison with the bc(1) complex. In: Biochimica et Biophysica Acta. Band 1459, Nummer 2–3, August 2000, S. 467–474, PMID 11004464.
- ↑ S. Saif Hasan, E. Yamashita, W. A. Cramer: Transmembrane signaling and assembly of the cytochrome b6f-lipidic charge transfer complex. In: Biochimica et Biophysica Acta. Band 1827, Nummer 11–12, 2013 Nov-Dec, S. 1295–1308, doi:10.1016/j.bbabio.2013.03.002, PMID 23507619, PMC 4029431 (freier Volltext).
- ↑ a b N. Fisher, B. Meunier: Effects of mutations in mitochondrial cytochrome b in yeast and man. Deficiency, compensation and disease. In: European Journal of Biochemistry. Band 268, Nummer 5, März 2001, S. 1155–1162, PMID 11231266
- ↑ J. Castresana: Cytochrome b phylogeny and the taxonomy of great apes and mammals. In: Molecular biology and evolution. Band 18, Nummer 4, April 2001, S. 465–471, PMID 11264397.
- ↑ S. N. Baharum, A. A. Nurdalila: Application of 16s rDNA and cytochrome b ribosomal markers in studies of lineage and fish populations structure of aquatic species. In: Molecular biology reports. Band 39, Nummer 5, Mai 2012, S. 5225–5232, doi:10.1007/s11033-011-1320-2, PMID 22167328.