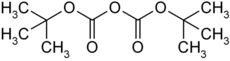
Di-tert-butyldicarbonat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Di-tert-butyldicarbonat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C10H18O5 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff oder Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 218,25 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,02 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Di-tert-butyldicarbonat [im Labor umgangssprachlich auch Boc-Anhydrid (Boc2O) oder Diboc genannt] ist eine flüssige, chemische Verbindung, die strukturell sowohl zu den Estern als auch zu den Säureanhydriden gerechnet werden kann.
Verwendung
Die hauptsächliche Verwendung von Di-tert-butyldicarbonat ist die Einführung der tert-Butyloxycarbonyl-Gruppe (Boc-Gruppe), einer der am häufigsten eingesetzten Schutzgruppen in der organischen Chemie. Es ist die meistgenutzte Chemikalie zum Schutz von Aminofunktionen bei chemischen Reaktionen, besonders in der Peptid- und Glycopeptidchemie.
Außerdem können mit Di-tert-butyldicarbonat primäre aliphatische und aromatische Amine, bei Anwesenheit katalytischer Mengen von 4-(Dimethylamino)pyridin (DMAP), in die entsprechenden Isocyanate überführt werden.[3]
Herstellung
Di-tert-butyldicarbonat wird weltweit nach zwei Verfahren hergestellt: Einerseits durch Umsetzung von Natrium- oder Kalium-tert-butylat mit Phosgen oder Phosgenderivaten und andererseits die katalytische Reaktion von Natrium-tert-butylat mit Kohlendioxid. Die Darstellung aus Kalium-tert-butanolat und Phosgen verläuft nach folgendem Schema:[4]
Spaltung
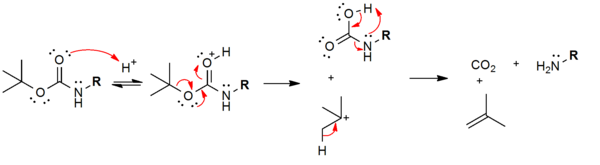
Die Boc-Schutzgruppe kann – im Gegensatz zur Cbz-Schutzgruppe – bereits mittels verdünnter wässriger Säure (≈3 M HCl) via E1-Schritt abgespalten werden. Die Spaltungsprodukte sind CO2 und Isobuten, beide sind flüchtig und kontaminieren so das entschützte Amin nicht. Boc ist außerordentlich stabil gegenüber Basen, sogar gegenüber OH−, da die Carbonylgruppe sterisch gehindert ist.[5]
Der Mechanismus der Spaltung:
Gefahren
Di-tert-butyldicarbonat ist beim Einatmen sehr giftig. Die LC50 bei Ratten ist 0,1 mg/L bei 4 h.[6]
Einzelnachweise
- ↑ a b c d e Datenblatt Di-tert-butyldicarbonat bei Merck, abgerufen am 19. Januar 2011.
- ↑ a b Eintrag zu Di-tert-butyldicarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- ↑ Hans-Joachim Knölker, Tobias Braxmeier, Georg Schlechtingen: A Novel Method for the Synthesis of Isocyanates Under Mild Conditions. In: Angewandte Chemie International Edition in English. 34, 1995, S. 2497–2500, doi:10.1002/anie.199524971.
- ↑ Barry M. Pope, Yutaka Yamamoto, and D. Stanley Tarbell: Dicarbonic acid, bis(1,1-dimethylethyl) ester In: Organic Syntheses. 57, 1977, S. 45, doi:10.15227/orgsyn.057.0045; Coll. Vol. 6, 1988, S. 418 (PDF).
- ↑ Jonathan Clayden, Nick Greeves, Stuart Warren: Organic Chemistry. Oxford University Press; 2. Auflage, 2012, S. 558.
- ↑ Sigma Aldrich: Sigma Aldrich SDS. Abgerufen am 17. Dezember 2020.