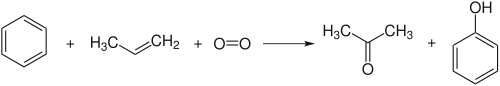E-Faktor
Der E-Faktor (eng.: Environmental Factor; oder auch Umweltfaktor) ist die erste allgemeine metrische Größe zur Prozessevaluation in der Chemie (grüne Chemie) und nach wie vor eine der flexibelsten und beliebtesten. Er wurde Ende der 80er Jahre von Roger A. Sheldon entwickelt.[1][2]
Beschreibung und Anwendung
Der E-Faktor wurde zur Bewertung der Umweltauswirkungen von chemischen Prozessen entwickelt.[1] Dieser Kennwert wird im Kontext der grünen Chemie verwendet, ähnlich dem Kennwert der Atomökonomie. Der E-Faktor ist definiert als das Massenverhältnis des Abfalls zum gewünschten Produkt.[1][3] Er kann dementsprechend folgendermaßen berechnet werden:
Für eine generische mehrstufiger Synthese, wobei nur R das gewünschte Produkte ist, ( ist der Stöchiometriefaktor):
lässt sich der E-Faktor wie folgt berechnen:
Ein höherer E-Faktor bedeutet mehr Abfall und folglich größere negative Umweltauswirkungen. Der ideale E-Faktor ist Null, d. h., nur das gewünschte Produkt entsteht und kein Abfall. Die wirtschaftlichen und ökologischen Kosten der Entsorgung dieser Abfälle führen dazu, dass eine Reaktion (oder eine Synthese) mit einem großen E-Faktor „weniger grün“ ist.
Der E-Faktor hebt die im Prozess entstehenden Abfälle hervor und hilft eines der zwölf Prinzipien der grünen Chemie zu erfüllen, nämlich die Vermeidung von Abfall. Es ist besser, Abfälle zu vermeiden, als Abfälle zu behandeln oder zu beseitigen, nachdem sie entstanden sind. Der E-Faktor ist leicht zu berechnen und erlaubt eine schnelle Abschätzung der entstehenden Abfallmengen. Das Ausmaß des Abfallproblems bei der Herstellung von Chemikalien wird deutlich, wenn die typischen E-Faktoren in verschiedenen Bereichen der chemischen Industrie betrachtet werden (siehe Tabelle 1).[1]
| Sektor | Menge Produkt / t | E-Faktor |
|---|---|---|
| Öl-Raffination | 106 – 108 | <0,1 |
| Grundchemikalie | 104 – 106 | <1 – 5 |
| Feinchemikalie | 102 – 104 | 5 – 50 |
| Arzneimittel | 10 – 103 | 25 – 100 |
Es ist auch offensichtlich, dass der E-Faktor von den Grundchemikalien hin zu den Feinchemikalien und Arzneimittel erheblich ansteigt. Einer der Gründe, warum der E-Faktor erheblich ansteigt ist die Tatsache, dass für die Produktion von Arzneimitteln mehrstufige Synthesen erforderlich sind. Die Pharmaunternehmen haben aber dabei betont, dass die absolute Abfallmenge geringer sei als bei den Grundchemikalien, da die Produktionsmengen der Arzneimittel auch viel geringer sind. Die größeren E-Faktoren bei den Feinchemikalien und den Arzneimitteln sind jedoch auch auf die weit verbreitete Verwendung klassischer stöchiometrischer Reagenzien anstelle von Katalysatoren in den Reaktionen zurückzuführen.[1] Seither wird der E-Faktor von der chemischen Industrie und insbesondere von der pharmazeutischen Industrie als nützliche Größe zur Bewertung der Umweltauswirkungen von Herstellungsprozessen verwendet.[3]
Beispiele
Berechnung des E-Faktors am Beispiel der industriellen Herstellung von Phenol
Die Chemikalie Phenol wird im industriellen Maßstab durch das Cumolhydroperoxid-Verfahren, welches auch als Phenolsynthese nach Hock (Hock-Verfahren) bekannt ist, hergestellt:
Um den E-Faktor dieser Reaktion zu berechnen müssen zunächst die Molmassen der Edukte und der Produkte ermittelt werden. O.B.d.A. wird die Masse des gewünschten Produkts Phenol auf 1000 g gesetzt, dies dient zur Vereinfachung der Rechnung. Demnach entspricht die Stoffmenge des gewünschten Produkts . Mit dieser lassen sich die Masse der anderen an der Reaktion beteiligten Moleküle ausrechnen. All diese Daten sind in der nachstehenden Tabelle dargestellt:
| Molmasse / | 78,11 | 42,08 | 31,98 | 58,08 | 94,11 | ||||
| Masse / | 829,99 | 447,14 | 339,82 | 617,15 | 1000 | ||||
| Stoffmenge / |
Nun müssen die passenden Werte in die oben beschriebene Formel eingesetzt werden (es wird für diese Berechnung eine Ausbeute von 100 % angenommen):
Folglich besitzt die industrielle Phenolsynthese nach dem Cumolhydroperoxid-Verfahren einen E-Faktor von 0,62. Die Chemikalie Phenol ist eine organische Grundchemikalie. Der ausgerechnete theoretische E-Faktor von 0,62 der Phenolsynthese stimmt verglichen mit den typischen E-Faktoren der Grundchemikalien, die im Bereich von kleiner 1 bis 5 liegen (siehe Tabelle 1), überein.
Grenzen des E-Faktors
Der E-Faktor ist eine Kenngröße für die Beurteilung der Nachhaltigkeit eines chemischen Prozesses. Wie alle Werte, die komplexe Prozesse in bestimmten Punkten beschreiben wollen besitzt der E-Faktor auch gewisse Grenzen:
- Der theoretische Wert und der praktische Wert liegen oft weit auseinander. Für den praktischen Wert ist eine experimentelle Durchführung notwendig.
- Lösungsmittel und Hilfsstoffe (Filterhilfen etc.), die ggf. auch als Abfall enden werden nicht miterfasst.
- Der E-Faktor für die Produktion der Edukte und für die Logistik (Transport ins Werk etc.) wird nicht erfasst.
- Der E-Faktor schließt automatisch das Wasser aus, das im Prozess verwendet wird, nicht aber Wasser, das gebildet wird.
Weblinks
- R. A. Sheldon: The E Factor. Abgerufen am 15. Juli 2022 (englisch).
- ACS (American Chemical Society): 12 Principles of Green Chemistry: Prevention. Abgerufen am 15. Juli 2022 (englisch).
Einzelnachweise
- ↑ a b c d e f Roger A. Sheldon: The E Factor: fifteen years on. In: Green Chemistry. Band 9, Nr. 12, 22. November 2007, ISSN 1463-9270, S. 1273–1283, doi:10.1039/B713736M (rsc.org [abgerufen am 14. Juli 2022]).
- ↑ R. A. Sheldon: Organic synthesis; past, present and future. Chem. Ind., London 1992, S. 903–906.
- ↑ a b Roger A. Sheldon: Fundamentals of green chemistry: efficiency in reaction design. In: Chemical Society Reviews. Band 41, Nr. 4, 30. Januar 2012, ISSN 1460-4744, S. 1437–1451, doi:10.1039/C1CS15219J (rsc.org [abgerufen am 14. Juli 2022]).