Natriumhydrogensulfit
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
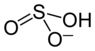
| Name | Natriumhydrogensulfit | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | NaHSO3 | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit (existiert nur in Lösung)[3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 104,06 g·mol−1 | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 5 mg·m−3 (gemessen als einatembarer Staub)[5] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Natriumhydrogensulfit (NaHSO3), auch Natriumbisulfit, ist ein Natrium-Salz der Schwefligen Säure. Es ist außerhalb von wässrigen Lösungen nicht stabil.
Darstellung
Eine wässrige Lösung von Natriumdisulfit ergibt Natriumhydrogensulfit.
Schwefeldioxid durch eine Lösung von Natriumcarbonat leiten ergibt ebenfalls Natriumhydrogensulfit.
Eigenschaften
Im Handel befindet es sich als Lösung mit einem zwischen 37 und 50 % liegenden Gehalt an Natriumhydrogensulfit. Diese Lösungen weisen ätzende, reduzierende und stark bleichende Eigenschaften auf. Beim Konzentrieren der wässrigen Lösung entsteht Natriumdisulfit (Na2S2O5) bzw. Natriumsulfit.
Von Bedeutung ist die Additionsreaktion mit Aldehyden oder Ketonen zu sogenannten Hydrogensulfitaddukten (Bisulfitaddukten), wobei sich der Schwefel des Hydrogensulfitions nukleophil an die Carbonylgruppe unter Bildung eines Hydroxyalkylsulfonations anlagert. Als Beispiel ist hier die Reaktion mit Formaldehyd unter Bildung des schwerlöslichen Natriumhydroxymethylsulfonats demonstriert:
- Fehler beim Parsen (MathML mit SVG- oder PNG-Rückgriff (empfohlen für moderne Browser und Barrierefreiheitswerkzeuge): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle \mathrm{HCHO + NaHSO_3 \longrightarrow HO{-}CH_2{-}SO_3Na}}
Die Hydrogensulfit-Addition wird häufig zur Aufreinigung von Aldehyden oder Ketonen verwendet, da sie unter basischen oder auch sauren Bedingungen reversibel ist.[7]
Verwendung
Als Lebensmittelzusatzstoff E 222 findet Natriumhydrogensulfit Verwendung als Konservierungsmittel z. B. bei der Stärke- und Zuckerherstellung, Antioxidationsmittel und als Stabilisator in Lebensmitteln sowie zur Analyse von Methylierungsmustern in DNA. Genutzt wird es auch als Reduktionsmittel in der chemischen Industrie zur Abwasserbehandlung. Es kommt auch in der Papierindustrie zum Einsatz.[8] Es wird in der Sulfomethylierung zur Herstellung von waschaktiven Substanzen, Ionentauschern und wasserlöslichen Harzen verwendet.[9]
Einzelnachweise
- ↑ Eintrag zu E 222: Sodium hydrogen sulphite in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 29. Dezember 2020.
- ↑ Eintrag zu SODIUM BISULFITE in der CosIng-Datenbank der EU-Kommission, abgerufen am 17. April 2020.
- ↑ a b c Eintrag zu Natriumhydrogensulfit, wässrige Lösung in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Eintrag zu Sodium hydrogensulfite im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7631-90-5 bzw. Natriumhydrogensulfit), abgerufen am 2. November 2015.
- ↑ Datenblatt Natriumhydrogensulfit bei Merck, abgerufen am 23. Juli 2008.
- ↑ Beyer-Walter: Lehrbuch der organischen Chemie, 23. Auflage, S. Hirzel Verlag, Stuttgart 1998.
- ↑ Grillo-Werke AG | NATRIUMBISULFIT FLÜSSIG. (grillo.de [abgerufen am 8. November 2018]).
- ↑ C. M. Suter, R. K. Bair, F. G. Bordwell: The sulfomethylation reaction. In: Journal of Organic Chemistry, 10.5, 1945, S. 470–478.



