Ellmans Reagenz
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
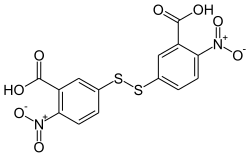
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Ellmans Reagenz | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C14H8N2O8S2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 396,35 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt |
240–245 °C (Zersetzung)[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Ellmans Reagenz (5,5′-Dithiobis-2-nitrobenzoesäure, DTNB) ist ein Stoff, der in der Biochemie zur Bestimmung der Menge an Thiolen in einer Probe verwendet wird.[2][3]
Eigenschaften
Thiole in Biomolekülen, insbesondere in Cystein-haltigen Proteinen und Peptiden, reagieren mit DTNB unter Freisetzung von 2-Nitro-5-thiobenzoat (TNB−), welches in neutralen und basischen Lösungen zum gelben Farbstoff TNB2− deprotoniert.
Die Menge an freigesetztem TNB− kann bei einer Wellenlänge von 412 nm photometrisch quantifiziert werden. Die Reaktion erfolgt in stöchiometrischem Verhältnis. Der Extinktionskoeffizient beträgt in verdünnten Lösungen 14.150 M−1 cm−1[4][5] und 13.700 M−1 cm−1 in höheren Salzkonzentrationen wie 6 M Guanidinhydrochlorid oder 8 M Harnstoff.[5] Für reproduzierbare Ergebnisse kann eine Umkristallisation des DTNB durchgeführt werden.
Alternativ kann 2,4-Dinitrobenzensulfonyl-Fluorescein oder 5-(2-Aminoethyl)dithio-2-nitrobenzoesäure verwendet werden.[6][7]
Synthese
Ellman stellte DTNB in mehreren Schritten her durch Oxidation von 2-Nitro-5-chlorbenzaldehyd zum Carboxylderivat, durch Erzeugung des Thiols mit Natriumsulfid und durch eine Oxidation der Thiolgruppen zu Disulfidbindungen mit Jod.[3]
Verwendung
Ellmans Reagenz kann zur Bestimmung von Glutathion und Thiolgruppen in Proteinen in gereinigten Lösungen oder in biologischen Proben wie Blut durchgeführt werden.[8][9][10] Bei der Reaktion mit freien Thiolgruppen entsteht das gelbliche p-Nitrophenyl, das spektroskopisch bei 412 nm detektierbar ist.[2]
Ellmans Reagenz kann ebenso verwendet werden, um schnell und spezifisch inter- und intramolekulare Disulfidbrücken zwischen Cysteinen von Peptiden auszubilden und zwar über eine große Bandbreite von pH-Werten. In Festphasensynthese werden damit große Ausbeuten erreicht, wobei wenig Oligomerisierung auftritt. Dabei bindet das Reagenz an zwei Seiten an die Festphase. Zu einer Thiolgruppe wird eine Bindung hergestellt. Eine zweite Thiolgruppe verdrängt das Reagenz und wird so mit der ersten zu einem Disulfid verknüpft. Die Thiolgruppen an Ellmans Reagenz werden dabei reduziert.[11]
Geschichte
DTNB wurde erstmals 1958 von George L. Ellman hergestellt.[2]
Weblinks
- Quantitation of sulfhydryls DTNB, Ellman’s reagent (PDF; 266 kB)
Einzelnachweise
- ↑ a b c Datenblatt 5,5′-Dithiobis(2-nitrobenzoic acid) bei Sigma-Aldrich, abgerufen am 17. Juli 2016 (PDF).
- ↑ a b c G. Ellman: A colorimetric method for determining low concentrations of mercaptans. In: Arch. Biochem. Biophys. 74, Nr. 2, 1958, S. 443–450. doi:10.1016/0003-9861(58)90014-6.
- ↑ a b Ellman GL: Tissue sulfhydryl groups. In: Arch. Biochem. Biophys.. 82, Nr. 1, 1959, S. 70–77. doi:10.1016/0003-9861(59)90090-6. PMID 13650640.
- ↑ Collier HB: Letter: A note on the molar absorptivity of reduced Ellman’s reagent, 3-carboxylato-4-nitrothiophenolate. In: Anal. Biochem.. 56, Nr. 1, 1973, S. 310–1. doi:10.1016/0003-2697(73)90196-6. PMID 4764694.
- ↑ a b P. W. Riddles, R. L. Blakeley, B. Zerner: Reassessment of Ellman's reagent. In: Methods in enzymology. Band 91, 1983, ISSN 0076-6879, S. 49–60, doi:10.1016/S0076-6879(83)91010-8, PMID 6855597.
- ↑ H. Maeda, H. Matsuno, M. Ushida, K. Katayama, K. Saeki, N. Itoh: 2,4-Dinitrobenzenesulfonyl fluoresceins as fluorescent alternatives to Ellman’s reagent in thiol-quantification enzyme assays. In: Angewandte Chemie (International ed. in English). Band 44, Nummer 19, Mai 2005, S. 2922–2925, ISSN 1433-7851. doi:10.1002/anie.200500114. PMID 15818626.
- ↑ J. Zhu, I. Dhimitruka, D. Pei: 5-(2-Aminoethyl)dithio-2-nitrobenzoate as a more base-stable alternative to Ellman’s reagent. In: Organic letters. Band 6, Nummer 21, Oktober 2004, S. 3809–3812, ISSN 1523-7060, doi:10.1021/ol048404+, PMID 15469355.
- ↑ Sedlak J, Lindsay RH: Estimation of total, protein-bound, and nonprotein sulfhydryl groups in tissue with Ellman’s reagent. In: Anal. Biochem.. 25, Nr. 1, 1968, S. 192–205. doi:10.1016/0003-2697(68)90092-4. PMID 4973948.
- ↑ Riener CK, Kada G, Gruber HJ: Quick measurement of protein sulfhydryls with Ellman’s reagent and with 4,4'-dithiodipyridine. In: Anal Bioanal Chem. 373, Nr. 4–5, 2002, S. 266–76. doi:10.1007/s00216-002-1347-2. PMID 12110978.
- ↑ R. J. Simpson: Estimation of Free Thiols and Disulfide Bonds Using Ellman’s Reagent. In: CSH protocols. Band 2008, 2008, S. pdb.prot4699, PMID 21356901.
- ↑ Annis I, Chen L, Barany G: Novel Solid-Phase Reagents for Facile Formation of Intramolecular Disulfide Bridges in Peptides under Mild Conditions. In: J. Am. Soc.. 120, Nr. 29, 1998, S. 7226–7238. doi:10.1021/ja981111p.

