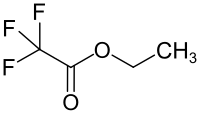
Ethyltrifluoracetat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ethyltrifluoracetat | |||||||||||||||
| Andere Namen |
Trifluoressigsäureethylester | |||||||||||||||
| Summenformel | C4H5F3O2 | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 142,08 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
1,192 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
60–62 °C[1] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,3070 (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Ethyltrifluoracetat ist eine chemische Verbindung aus der Gruppe der Trifluoracetate.
Gewinnung und Darstellung
Ethyltrifluoracetat kann durch Reaktion von 2,4,6-tris-(Trifluormethyl)-1,3,5-triazin mit Ethanol in Gegenwart von Salzsäure gewonnen werden. Ersteres lässt sich wiederum durch eine zweistufige Reaktion ausgehend von Trichloracetonitril durch Reaktion mit Chlorwasserstoff und der Fluorierung des Zwischenproduktes mit Antimontrifluorid darstellen.[2]
Die Verbindung kann auch durch Reaktion von Trifluoressigsäure oder Natriumtrifluoracetat[3] mit Ethanol gewonnen werden.[4]
Eigenschaften
Ethyltrifluoracetat ist eine farb- und geruchlose Flüssigkeit, die wenig löslich in Wasser, aber mischbar mit Chloroform und Methanol ist.[1] Die Verbindung liegt in der Gasphase in zwei konformeren Formen vor.[5]
Verwendung
Ethyltrifluoracetat wird als Zwischenprodukt in der organischen Synthese verwendet, um organische Fluorverbindungen wie 3-Ethyl-1-methylimidazoliumtrifluoracetat (EMITA) herzustellen. Es wird auch bei der Synthese verschiedener pharmazeutisch aktiver Moleküle und landwirtschaftlicher Produkte eingesetzt und ist auch für die Herstellung von trifluoracylierten Verbindungen nützlich.[1] Die Trifluoracetylgruppe ist als Aminschutzgruppe in der organischen Synthese weit verbreitet, da sie unter milden Bedingungen leicht entfernt werden kann.[6]
Einzelnachweise
- ↑ a b c d e f g h i j k l Datenblatt Ethyl trifluoroacetate, 99% bei AlfaAesar, abgerufen am 6. August 2022 (PDF) (JavaScript erforderlich).
- ↑ T. R. Norton: A New Synthesis of Ethyl Trifluoroacetate. In: Journal of the American Chemical Society. Band 72, Nr. 8, 1950, ISSN 0002-7863, S. 3527–3528, doi:10.1021/ja01164a056 (acs.org).
- ↑ R. L. Murray, J. H. Babcock: The Preparation of Sodium Trifluoroacetate and Ethyl Trifluoroacetate. Atomic Energy Commission, 1946 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Google Patents: US4879407A - Process for the preparation of ethyl trifluoroacetate - Google Patents, abgerufen am 7. August 2022
- ↑ María Eliana Defonsi Lestard, María Eugenia Tuttolomondo, Derek A. Wann, Heather E. Robertson, David W. H. Rankin, Aida Ben Altabef: Experimental and theoretical structure and vibrational analysis of ethyl trifluoroacetate, CF3CO2CH2CH3: Structure and vibrational analysis of CF3CO2CH2CH3. In: Journal of Raman Spectroscopy. Band 41, Nr. 10, 2010, S. 1357–1368, doi:10.1002/jrs.2550 (wiley.com).
- ↑ Daqiang Xu, Kapa Prasad, Oljan Repic, Thomas J. Blacklock: Ethyl trifluoroacetate: a powerful reagent for differentiating amino groups. In: Tetrahedron Letters. Band 36, Nr. 41, 1995, ISSN 0040-4039, S. 7357–7360, doi:10.1016/0040-4039(95)01655-4 (sciencedirect.com).

