Ferrier-Reaktion
Die Ferrier-Reaktion ist eine Namensreaktion der organischen Chemie. 1914 berichtete der deutsche Chemie-Nobelpreisträger Emil Fischer (1852–1919) erstmals von dieser Reaktion. Die Umlagerung findet in Gegenwart einer Lewis-Säure an ungesättigten Verbindungen statt. Bei dieser Umlagerungsreaktion wird häufig auch vom Typ I der Ferrier-Umlagerung gesprochen.[1]
Übersichtsreaktion
Die synthetische Nützlichkeit der Ferrier-Reaktion erkannte Robert J. Ferrier in den frühen 1960ern, in dem er erfolgreich Sauerstoff-, Schwefel- und Stickstoff-gebundene ungesättigte Glycosyl-Verbindungen aus 1,2-Glycal und Nukleophilen in Gegenwart einer Lewis-Säure synthetisierte.[1][2][3][4] Die besonderen Merkmale dieser Reaktion sind:
- gute Abgangsgruppen an den Ausgangsverbindungen, die sich auch ohne die Verwendung von Lewis-Säuren unter Bedingungen einer Mitsunobu-Reaktion aktivieren lassen (z. B. Tosylate)[5]
- die Verwendung von üblichen Lewis-Säuren (z. B. FeCl3)[6]
- die Stereochemie des Produktes am anomeren Zentrum hängt mit der Stereochemie des Eduktes zusammen, wobei das α-Anomer normalerweise dominiert[1]
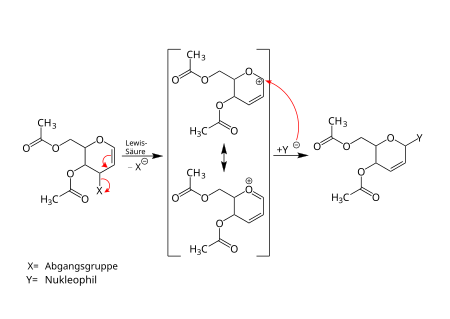
Reaktionsmechanismus
Im ersten Schritt des vorgeschlagenen Reaktionsmechanismus des Typ I der Ferrier-Reaktion verlässt die Abgangsgruppe das 1,2-Glycal unter Verwendung einer Lewis-Säure. Das entstandene mesomeriestabilisierte Zwischenprodukt wird anschließend von dem Nukleophil angegriffen und die entsprechende 2,3-ungesättigte Glycosylverbindung entsteht.[1][7][8][9][10][11][12][13]
Anwendung
Der Typ I der Ferrier-Reaktion wurde im Labor von H.M.I. Osborn verwendet, um ungesättigte β-C-Disaccharide zu bilden.[14] Auch D.R. Williams und seine Mitarbeiter bedienten sich der Umlagerung, um (+)-4,5-Deoxyneodolabellin zu synthetisieren.[1][15]
Siehe auch
Einzelnachweise
- ↑ a b c d e László Kürti, Barbara Czakó: Strategic applications of named reactions in organic synthesis : background and detailed mechanisms. Elsevier Academic Press, Amsterdam 2005, ISBN 0-12-429785-4, S. 168–169.
- ↑ R. J. Ferrier, W. G. Overend, A. E. Ryan: 712. The reaction between 3,4,6-tri-O-acetyl-D-glucal and p-nitrophenol. In: Journal of the Chemical Society (Resumed). 1962, S. 3667–3670, doi:10.1039/jr9620003667.
- ↑ R. J. Ferrier: 1038. Unsaturated carbohydrates. Part II. Three reactions leading to unsaturated glycopyranosides. In: Journal of the Chemical Society (Resumed). 1964, S. 5443–5449, doi:10.1039/jr9640005443.
- ↑ R. J. Ferrier, N. Prasad, G. H. Sankey: Unsaturated carbonhydrates. Part VIII. Intramolecular allylic isomerisations of 1-deoxyald-1-enopyranose (2-hydroxyglycal) esters. In: Journal of the Chemical Society C: Organic. 1968, S. 974–977, doi:10.1039/j39680000974.
- ↑ Aditya Sobti, Gary A. Sulikowski: Mitsunobu reactions of glycals with phenoxide nucleophiles are SN2′-selective. In: Tetrahedron Letters. Band 35, Nr. 22, Mai 1994, S. 3661–3664, doi:10.1016/S0040-4039(00)73065-6.
- ↑ Masato Koreeda, Todd A. Houston, Brian K. Shull, Erich Klemke, Roeland J. Tuinman: Iodine-catalyzed Ferrier Reaction 1. A Mild and Highly Versatile Glycosylation of Hydroxyl and Phenolic Groups1. In: Synlett. Band 1995, Nr. 01, Januar 1995, S. 90–92, doi:10.1055/s-1995-4873.
- ↑ R. J. Ferrier, N. Prasad: Unsaturated carbohydrates. Part IX. Synthesis of 2,3-dideoxy-α- D -erythro-hex-2-enopyranosides from tri-O-acetyl- D -glucal. In: J. Chem. Soc. C. Band 0, Nr. 4, 1969, S. 570–575, doi:10.1039/J39690000570.
- ↑ R.D. (Gus) Guthrie, Robert W. Irvine: Allylic substitutions in tri-O-acetyl-glycals and related compounds. In: Carbohydrate Research. Band 82, Nr. 2, 1980, S. 207–224, doi:10.1016/S0008-6215(00)85698-0 (elsevier.com [abgerufen am 23. April 2019]).
- ↑ Antonio S. Machado, Didier Dubreuil, Jeannine Cleophax, Stephane D. Gero, Noel F. Thomas: Expedient syntheses of inososes from carbohydrates: conformational and stereoelectronic aspects of the Ferrier reaction. In: Carbohydrate Research. Band 233, 1992, S. C5–C8, doi:10.1016/S0008-6215(00)90945-5.
- ↑ Noriaki Yamauchi, Takumi Terachi, Tadashi Eguchi, Katsumi Kakinuma: Mechanistic and stereochemical studies on Ferrier reaction by means of chirally deuterated glucose. In: Tetrahedron. Band 50, Nr. 14, 1994, S. 4125–4136, doi:10.1016/S0040-4020(01)86708-9.
- ↑ Didier Dubreuil, Jeannine Cleophax, Mauro Vieira de Almeida, Catherine Verre-Sebrié, Jérôme Liaigre: Stereoselective synthesis of 6-deoxy and 3,6-dideoxy-D-myo-inositol precursors of deoxy-myo-inositol phosphate analogues from D-galactose. In: Tetrahedron. Band 53, Nr. 49, Dezember 1997, S. 16747–16766, doi:10.1016/S0040-4020(97)10101-6.
- ↑ Leo A. Paquette, Margaret J. Kinney, Uta Dullweber: Practical Synthesis of Spirocyclic Bis-C,C-glycosides. Mechanistic Models in Explanation of Rearrangement Stereoselectivity and the Bifurcation of Reaction Pathways. In: The Journal of Organic Chemistry. Band 62, Nr. 6, 1997, S. 1713–1722, doi:10.1021/jo962020i.
- ↑ Robert J. Ferrier: Substitution-with-Allylic-Rearrangement Reactions of Glycal Derivatives. In: Topics in Current Chemistry. Springer Berlin Heidelberg, Berlin, Heidelberg 2001, ISBN 978-3-540-41383-7, S. 153–175.
- ↑ Natasha Gemmell, Paul Meo, Helen M. I. Osborn: Stereoselective Entry to β-Linked C -Disaccharides Using a Carbon-Ferrier Reaction. In: Organic Letters. Band 5, Nr. 10, 2003, S. 1649–1652, doi:10.1021/ol030023t.
- ↑ David R. Williams, Richard W. Heidebrecht: Total Synthesis of (+)-4,5-Deoxyneodolabelline. In: Journal of the American Chemical Society. Band 125, Nr. 7, 2003, S. 1843–1850, doi:10.1021/ja0279803.