Glutathion-Reduktase
aus Wikipedia, der freien Enzyklopädie
| Glutathion-Reduktase | ||
|---|---|---|

| ||
| Bändermodell der GSR des Menschen, nach PDB 1GRE | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 479 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | FAD | |
| Präkursor | (522 aa) | |
| Isoformen | M, C, 2, 3, 4 | |
| Bezeichner | ||
| Gen-Name | GSR | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.8.1.7, Oxidoreduktase | |
| Reaktionsart | Redoxreaktion | |
| Substrat | GSSG + NADPH/H+ | |
| Produkte | 2 GSH + NADP+ | |
| Vorkommen | ||
| Übergeordnetes Taxon | Tiere, Pilze, manche Bakterien[1] | |
Die Glutathion-Reduktase (GSR) (genauer: Glutathiondisulfid-Reduktase) ist das Enzym, das Glutathiondisulfid (GSSG) zu Glutathion (GSH) reduziert. Dabei wird ein Reduktionsäquivalent (NADPH/H+) verbraucht, das aus dem Pentosephosphatweg stammt. Die Reaktion findet in Tieren, Pilzen und verschiedenen Bakterien statt und dient zur Wiederherstellung von Glutathion, nachdem es oxidiert wurde.[2]
Beim Menschen können aus dem GSR-Gen mehrere Spleißvarianten des Enzyms entstehen, die sich durch ihre Lokalisierung (mitochondriell, cytosolisch) unterscheiden. Mutationen in GSR können zu erblicher verringerter Enzymaktivität mit hämolytischer Anämie führen.[3]
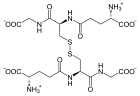
Katalysierte Reaktion
Ein Molekül Glutathiondisulfid wird zu zwei Molekülen Glutathion reduziert.
Einzelnachweise
Weblinks
Wikibooks: Biochemie und Pathobiochemie: Glutathion-Stoffwechsel – Lern- und Lehrmaterialien