Gold(III)-fluorid
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| _ Au3+ _ F− | |||||||
| Kristallsystem |
hexagonal | ||||||
| Raumgruppe |
P6122 (Nr. 178) | ||||||
| Gitterparameter | |||||||
| Allgemeines | |||||||
| Name | Gold(III)-fluorid | ||||||
| Andere Namen |
Goldtrifluorid | ||||||
| Verhältnisformel | AuF3 | ||||||
| Kurzbeschreibung |
orange-gelber Feststoff[2] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 253,96 g·mol−1 | ||||||
| Aggregatzustand |
fest[2] | ||||||
| Dichte |
6,75 g·cm−3[2] | ||||||
| Schmelzpunkt | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Gold(III)-fluorid ist eine anorganische chemische Verbindung des Golds aus der Gruppe der Fluoride.
Gewinnung und Darstellung
Gold(III)-fluorid kann durch Pyrolyse von Gold(V)-fluorid bei 200 °C oder durch Fluorierung von Gold(III)-chlorid gewonnen werden.[4]
Es kann auch durch Fluorierung von Gold mit Brom(III)-fluorid dargestellt werden.[5]
Eigenschaften
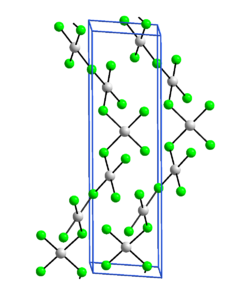
Gold(III)-fluorid ist ein diamagnetischer orange-gelber Feststoff.[2] Er zersetzt sich bei 500 °C. Seine Kristallstruktur ist isotyp zu der von Silber(III)-fluorid (hexagonal, Raumgruppe P6122 (Raumgruppen-Nr. 178), und ist aus quadratisch-planaren AuF4 Einheiten aufgebaut.[4] Jede AuF4-Einheit ist dabei mit zwei anderen Einheiten verbunden, so dass sich spiralförmige Ketten ergeben.
Mit Fluoridionen bildet Gold(III)-fluorid Fluoroaurate(III) [AuF4]− und [Au2F7]−. Das [AuF4]−-Ion kommt auch im Au3F8 (Gold(II)-bis-tetrafluoroaurat(III)) vor.[6]
Verwendung
Gold(III)-fluorid kann zur Herstellung von Goldaziden verwendet werden.[7]
Einzelnachweise
- ↑ B. Zemva, K. Lutar, A. Jesih, W.J. Casteel Jr., A.P. Wilkinson, D.E. Cox, R.B. von Dreele, H. Borrman, N. Bartlett: Silver Trifluoride: preparation, crystal structure, some properties, and comparison with AuF3. In: Journal of the American Chemical Society, 1991, 113, S. 4192–4198 doi:10.1021/ja00011a021.
- ↑ a b c d e Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis US, 2011, ISBN 1-4398-1461-9, S. 191 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 3-11-022567-0, S. 759 f. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Mido & S. Taguchi: Chemistry in Aqueous and Non-aqueous Solvents. Discovery Publishing House, 1997, ISBN 81-7141-331-5, S. 158 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ R. Schmidt, B. G. Müller: Einkristalluntersuchungen an Au[AuF4]2 und CeF4, zwei unerwarteten Nebenprodukten. In: Zeitschrift für anorganische und allgemeine Chemie, 1999, 625, S. 605–608 (doi:10.1002/(SICI)1521-3749(199904)625:4<605::AID-ZAAC605>3.0.CO;2-6).
- ↑ Herbert W. Roesky: Efficient Preparations of Fluorine Compounds. John Wiley & Sons, 2012, ISBN 1-118-40942-6, S. 96 (eingeschränkte Vorschau in der Google-Buchsuche).