Gold(III)-selenat
| Kristallstruktur | |||||||||
|---|---|---|---|---|---|---|---|---|---|
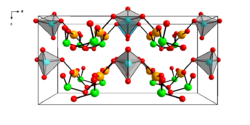
| |||||||||
| _ Au3+ _ Se4+ _ Se6+ _ O2− | |||||||||
| Allgemeines | |||||||||
| Name | Gold(III)-selenat | ||||||||
| Andere Namen |
Goldtriselenat | ||||||||
| Verhältnisformel | Au2(SeO4)3 | ||||||||
| Kurzbeschreibung |
gelber Feststoff[1] | ||||||||
| Externe Identifikatoren/Datenbanken | |||||||||
| |||||||||
| Eigenschaften | |||||||||
| Molare Masse | 822,81 g·mol−1 | ||||||||
| Aggregatzustand |
fest[1] | ||||||||
| Schmelzpunkt | |||||||||
| Löslichkeit | |||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Gold(III)-selenat ist die historische Bezeichnung des Reaktionsprodukts von Gold mit Selensäure.
Nach neueren Quellen ist jedoch davon auszugehen, dass die so bezeichnete chemische Verbindung nicht der Gruppe der Selenate zugehörig ist, sondern ein Selenitselenat vorliegt.
Gewinnung und Darstellung
Gold(III)-selenat kann durch Reaktion von heißer konzentrierter Selensäure mit Gold gewonnen werden.[5] Neuere Quellen geben die Zusammensetzung der entstandenen Verbindung als Au2(SeO3)2(SeO4) an, weswegen sie als Goldselenitselenat bezeichnet werden müsste.[2]
Das Auflösen von elementarem Gold mit konzentrierter Selensäure unter Bildung von Goldselenaten wurde 1827 von Eilhard Mitscherlich zum ersten Mal beschrieben. V. Lenher konnte durch die Isolierung von gelben Kristallen, denen er die Summenformel Au2(SeO4)3 zuschrieb, die Existenz von Goldselenaten weiter belegen.[6][7][8] Bei Röntgenstrukturuntersuchungen der dargestellten und strukturell charakterisierten Verbindungen erwiesen sich diese aber alle als Selenite bzw. Diselenite des Golds.[9][10]
Eigenschaften
Gold(III)-selenat ist ein gelber Feststoff, der praktisch unlöslich in Wasser ist.[1] Er färbt sich jedoch unter Licht und Luft dunkel.[11] Die Verbindung besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Cmc21 (Raumgruppen-Nr. 36) mit den Gitterparametern a = 16,89 Å, b = 6,301 Å und c = 8,327 Å.[2] Die Elementarzelle enthält vier Formeleinheiten. Das Au3+-Ion ist quadratisch-planar von vier Sauerstoffatomen umgeben.[6] Mit Perchlorsäure reagiert die Verbindung zu dem triklinen Gold(III)-selenitchlorid Au(SeO3)Cl.[12]
Einzelnachweise
- ↑ a b c d e
- ↑ a b c Mathias S. Wickleder, Oliver Büchner, Claudia Wickleder, Sherif el Sheik, Gunther Brunklaus, Hellmut Eckert: Au2(SeO3)2(SeO4): Synthesis and Characterization of a New Noncentrosymmetric Selenite−Selenate. In: Inorganic Chemistry. 43, 2004, S. 5860, doi:10.1021/ic049270z.
- ↑ Eintrag zu Selenverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Juli 2021. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Selenverbindungen mit Ausnahme von Cadmiumsulfoselenid, soweit in diesem Anhang nicht gesondert aufgeführt im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 25. Juli 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑
- ↑ a b Oliver Büchner: Münzmetalle mit und in komplexen Anionen: Synthese, Struktur und Eigenschaften, Dissertation, Fakultät für Mathematik und Naturwissenschaften der Carl von Ossietzky Universität Oldenburg, 2005.
- ↑ E. Mitscherlich, Pogg. Ann. 1827, 9, 623.
- ↑ V. Lenher, J. Am. Chem. Soc. 1902, 24, 354.
- ↑ P. G. Jones, E. Schwarzmann, G. M. Sheldrick, H. Timpe: Darstellung und Struktur von Di-gold(III)bis(selenit)(diselenit), Au2(SeO3)2(Se2O5). In: Zeitschrift für Naturforschung B. 36, 1981, S. 1050–1051 (online).
- ↑ P. G. Jones, G. M. Sheldrick, E. Schwarzmann, A. Vielmäder: Darstellung und Kristallstruktur von Di-gold(III)bis(selenit)oxid, Au2(SeO3)2O. In: Zeitschrift für Naturforschung B. 38, 1983, S. 10–11 (PDF, freier Volltext).
- ↑ John Raymond Mickelsen: Coloring Glass with Gold Selenate. Oregon State College, 1953 (oregonstate.edu [PDF]).
- ↑ Peter G. Jones, Martin Kraushaar, Einhard Schwarzmann, George M. Sheldrick: Darstellung und Kristallstruktur von Gold(III)selenitchlorid, Au(SeO3)Cl. In: Zeitschrift für Naturforschung B. 37, 1982, S. 941–943 (PDF, freier Volltext). doi:10.1515/znb-1982-0802.



