Hexanitroethan
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Hexanitroethan | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C2N6O12 | ||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 300,0544 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
1,85 g·cm−3 (20 °C)[2] | ||||||||||||
| Schmelzpunkt |
135,5 °C[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Hexanitroethan ist eine aliphatische Nitroverbindung. Im Molekül sind alle sechs möglichen Substituentenpositionen jeweils durch eine Nitrogruppe ersetzt. Als hochnitrierte Verbindung wirkt es als starkes Oxidationsmittel und ist ein Explosivstoff.
Darstellung und Gewinnung
Eine erste Herstellung wurde schon 1914 durch Wilhelm Will beschrieben.[4] Diese gelingt durch die Umsetzung des Kaliumsalzes des Tetranitroethans mit Salpetersäure.[1]
Das Kaliumsalz des Tetranitroethans kann in einer Synthesesequenz ausgehend vom Tribromnitromethan gewonnen werden.[1] Im ersten Schritt erfolgt eine Dimerisierung zum Tetrabromdinitroethan.
Im zweiten Schritt erfolgt eine nucleophile Substitution mit Kaliumnitrit zum Dibromtetranitroethan.
Das Tetranitroethansalz entsteht dann durch die weitere Umsetzung mit Kaliumcyanid.
Eine für eine industrielle Herstellung praktikable Synthese geht von Furfural aus,[5] welches im ersten Schritt unter Ringöffnung oxidativ zur Mucobromsäure (2,3-Dibrommalealdehydsäure) bromiert wird.[6] Alternativ kann auch Furan-2-carbonsäure als Edukt verwendet werden.[7] Im Folgeschritt wird die Mucobromsäure bei Temperaturen kurz unterhalb von Raumtemperatur mit Kaliumnitrit zum Dikaliumsalz des 2,3,3-Trinitropropionaldehyds umgesetzt.[5] Die Zielverbindung erhält man durch die Nitrierung dieses Salzes mittels Salpetersäure und Schwefelsäure bei −60 °C.[5]
Eigenschaften
Hexanitroethan kann in zwei polymorphen Kristallformen auftreten.[8] Unterhalb einer Temperatur von 18 °C liegt die Kristallform II vor. Am Umwandlungspunkt bei 18 °C erfolgt die Bildung der Kristallform I mit einer Umwandlungsenthalpie von 12,4 kJ·mol−1.[8] Die Kristallform I schmilzt bei 135,5 °C.[2]
Hexanitroethan ist ein explosionsgefährlicher Stoff im Sinne des Sprengstoffgesetzes. Wichtige Explosionskennzahlen sind:
Tabelle mit wichtigen explosionsrelevanten Eigenschaften: Sauerstoffbilanz 42,7 %[2] Stickstoffgehalt 28,01 %[2] Normalgasvolumen 678 l·kg−1[2] Explosionswärme 3020 kJ·kg−1[2] Spezifische Energie 813 kJ·kg−1 (68,1 mt/kg)[2] Bleiblockausbauchung 24,5 cm3·g−1[2] Detonationsgeschwindigkeit 4950 m·s−1[2] Verpuffungspunkt 175 °C[2] Schlagempfindlichkeit 10 Nm[2] Reibempfindlichkeit mit 253 N Stiftbelastung Zersetzung[2]
Die thermische Zersetzung wurde am Feststoff und in Lösung schon ab 60 °C detektiert.[9] Oberhalb von 140 °C kann die Zersetzung explosionsartig erfolgen.[10] Die Zersetzung verläuft als Reaktion erster Ordnung. Die Reaktionsgeschwindigkeit ist dabei in Lösung signifikant höher als im Feststoff.[9] Für die Zersetzung des Feststoffs kann die folgende Gleichung formuliert werden.[9]
Bei der Zersetzung in Lösung wird im ersten Schritt Tetranitroethylen gebildet, welcher über seine Diels-Alder-Addukte z. B. mit Anthracen oder Cyclopentadien nachgewiesen werden kann.[11][12]
Bei der Umsetzung in Alkoholen unter Rückfluss erfolgt eine Addition an das intermediär gebildete Tetranitroethylen. Die gebildete Dinitroalkoxyalkylstruktur ist nicht stabil und bildet nach Umlagerung der Nitrogruppe zum Salpetrigsäureester und Abspaltung von Stickoxiden den entsprechenden Ester der Dinitroessigsäure.[12]
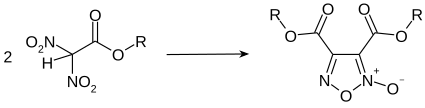
Der Dinitroessigsäureester dimerisiert bei der Lagerung langsam zum entsprechenden 3,4-Bis(alkoxycarbonyl)furazan-2-oxid.[12][13] Bei höheren Temperaturen kann der Dinitroessigsäureester zum Dinitromethan verseift und decarboxyliert werden.[13]
Verwendung
Hexanitroethan kann in Treibsätzen als sauerstoffausgleichender Zusatz eingesetzt werden.[2]
Einzelnachweise
- ↑ a b c Urbanski, T.: Chemistry and Technology of Explosives, Vol. 1, Pergamon Press/PWN - Polish Scientific Publishers 1964, S. 596.
- ↑ a b c d e f g h i j k l m n Köhler, J.; Meyer, R.; Homburg, A.: Explosivstoffe, zehnte, vollständig überarbeitete Auflage. Wiley-VCH, Weinheim 2008, S. 165, ISBN 978-3-527-32009-7.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Will, W.: Über das Hexanitro-äthan in Chemische Berichte 47 (1914) 961–965, doi:10.1002/cber.191404701154.
- ↑ a b c Patent US3101379A: Synthesis of hexanitroethane. Angemeldet am 4. Januar 1961, veröffentlicht am 20. August 1963, Anmelder: Lockheed Aircraft Corp, Erfinder: John A. Gallahan, Ben Lomond, Wilmer L. Reed.
- ↑ Taylor, G.A.: Mucobromic Acid. In: Organic Syntheses, Coll. Vol. 4 (1963), S. 688, doi:10.1002/0471264180.os900.13 (PDF).
- ↑ Allen, C.F.H.; Spangler, F.W.: Mucobromic Acid In: Organic Syntheses. 27, 1947, S. 60, doi:10.15227/orgsyn.027.0060; Coll. Vol. 3, 1955, S. 621 (PDF).
- ↑ a b Krien, G.; Licht, H.H.; Trimborn, F.: A phase transition of hexanitroethane (HNE) in Explosivstoffe 9 (1970) 203–207.
- ↑ a b c Marshall, H.P.; Borgardt, F.G.; Noble, Jr. P.: Thermal Decomposition of Hexanitroethan in J. Phys. Chem. 69 (1965) 25–29, doi:10.1021/j100885a007.
- ↑ P.G. Urben; M.J. Pitt: Bretherick's Handbook of Reactive Chemical Hazards. 8. Edition, Vol. 1, Butterworth/Heinemann 2017, ISBN 978-0-08-100971-0, S. 240–241.
- ↑ Griffin, T.S.; Baum, K.: Tetranitroethylene. In Situ Formation and Diels-Alder Reactions in J. Org. Chem. 45 (1980) 2880–2883, doi:10.1021/jo01302a024.
- ↑ a b c Tseng, D.; Baum, K.: Reactions of Hexanitroethane with alcohols in J. Org. Chem. 48 (1983) 5384–5385, doi:10.1021/jo00174a053.
- ↑ a b Grakauskas, V.; Guest, A. M.: Dinitromethane in J. Org. Chem. 43 (1978) 3485–3488, doi:10.1021/jo00412a014.