Hydroxylaminhydrochlorid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
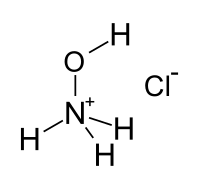
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hydroxylaminhydrochlorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | [NH3OH]Cl | |||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 69,49 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,67 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Hydroxylaminhydrochlorid, auch als Hydroxylammoniumchlorid bezeichnet, ist eine farblose, kristalline anorganische chemische Verbindung. Es ist das Salzsäuresalz des Hydroxylamins und verhält sich in den meisten chemischen Reaktionen wie ungebundenes Hydroxylamin, ist aber thermisch stabiler.
Herstellung
Hydroxylaminhydrochlorid ist zugänglich durch
- Elektrolyse einer Mischung aus Quecksilbernitrat, Schwefelsäure und Salpetersäure (dabei entsteht das Sulfat) und anschließender Zugabe von Bariumchloridlösung.
- durch Kochen von Kaliumhydroxylamindisulfonat, wobei wie oben das Sulfat entsteht, aus dem das Produkt mit Bariumchlorid erhalten wird.[4]
Eigenschaften
Hydroxylaminhydrochlorid reagiert mit Aldehyden oder Ketonen zu Oximen und mit Carbonsäuren zu Hydroxamsäuren.
Verwendung
Hydroxylaminhydrochlorid ist ein vielseitig einsetzbares Reagenz in der pharmazeutischen und organischen Synthese, zum Beispiel zur Synthese von Oximen und Oximethern aus Carbonylverbindungen oder zur Synthese von Hydroxamsäuren. In der Analytik findet es Einsatz in der Oximtitration.
Rechtsstatus
In Deutschland ist Hydroxylaminhydrochlorid entsprechend den Regelungen des Sprengstoffgesetzes als explosionsgefährlicher Stoff der Stoffgruppe C eingestuft.[5]
Literatur
- Eintrag zu Hydroxylammoniumchlorid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
Einzelnachweise
- ↑ a b Eintrag zu Hydroxylammoniumchlorid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- ↑ a b c d e Eintrag zu Hydroxylammoniumchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ Eintrag zu Hydroxylammonium chloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 487–8.
- ↑ Bekanntmachung der gemäß § 2 SprengG von der BAM seit 1987 neu getroffenen Feststellungen. (PDF)




