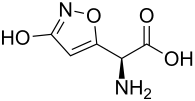
Ibotensäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ibotensäure | |||||||||||||||
| Andere Namen |
(S)-2-Amino-2-(3-hydroxyisoxazol-5-yl)essigsäure | |||||||||||||||
| Summenformel | C5H6N2O4 | |||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 158,11 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Ibotensäure, auch Prämuscimol genannt, ist eine psychoaktive, nicht-proteinogene L-Aminosäure (racemisiert bei der Isolation), die in verschiedenen Pilzen aus der Gattung Wulstlinge vorkommt, beispielsweise im Fliegenpilz und Pantherpilz.[5][6]
Biologische Bedeutung

Ibotensäure dient wie andere Pilzgifte der Abwehr von Fraßinsekten. Sie ist die metabolische Vorstufe von in Trockenpilzen enthaltenem Muscimol.[5] Als Bestandteil der farbgebenden Komponenten der Fliegenpilzfarbstoffe wurde ein Ibotensäure-Betalaminsäure-Konjugat (Musca-aurin I), ein Betaxanthin, identifiziert.
Die Biosynthese der Ibotensäure beginnt höchstwahrscheinlich mit Hydroxylierung von Glutamat mithilfe einer Eisen/2-Ketoglutarat-abhängigen Oxygenase. Das gebildete threo-3-Hydroxyglutamat wird dann in mehreren enzymatischen Stufen in Ibotensäure umgewandelt.[8]
Wirkung
Ibotensäure ist ein Pilzgift mit zentralnervöser Wirkung.[9] Es führt anfänglich zu einer dem Alkoholrausch ähnlichen Symptomatik mit Gangunsicherheit, später zu motorischer Lähmung, aber auch zu Hyperkinese, Muskelkrämpfen und Delirium.
Ibotensäure bindet an Glutamatrezeptoren der Zunge und löst einen Umami-Geschmack aus.[10][11]
Beim Garen sowie bei der Trocknung wandelt sich Ibotensäure durch Decarboxylierung in Muscimol um, dessen halluzinogene Wirkung deutlich stärker ist.[12]
Einzelnachweise
- ↑ a b c Eintrag zu Ibotensäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- ↑ a b Datenblatt Ibotenic acid bei Sigma-Aldrich, abgerufen am 4. April 2011 (PDF).
- ↑ Eintrag zu Ibotenic acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- ↑ Oliver Sauer: Drogen. Schlütersche, 2001, ISBN 978-3-877-06601-0, S. 67.
- ↑ a b Franz-Xaver Reichl: Taschenatlas der Toxikologie. Georg Thieme Verlag, 2002, ISBN 978-3-131-08972-4, S. 272.
- ↑ Norio Nakamura: The Improved Syntheses of dl-Ibotenic Acid and Muscimol. In: CHEMICAL & PHARMACEUTICAL BULLETIN. Band 19, Nr. 1, 1971, ISSN 0009-2363, S. 46–51, doi:10.1248/cpb.19.46 (jst.go.jp [abgerufen am 11. April 2020]).
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 483, ISBN 978-3-906390-29-1.
- ↑ Sebastian Obermaier, Michael Müller: Ibotenic Acid Biosynthesis in the Fly Agaric Is Initiated by Glutamate Hydroxylation. In: Angewandte Chemie International Edition. 31. März 2020, doi:10.1002/anie.202001870 (wiley.com [abgerufen am 11. April 2020]).
- ↑ Ernst Steinegger: Lehrbuch der Pharmakognosie und Phytopharmazie. Springer-Verlag, 2013, ISBN 978-3-662-08318-5, S. 446.
- ↑ Hans-Dieter Belitz, Werner Grosch: Lehrbuch der Lebensmittelchemie. Springer-Verlag, 2007, ISBN 978-3-540-73202-0, S. 442.
- ↑ H. N. Lioe, J. Selamat, M. Yasuda: Soy sauce and its umami taste: a link from the past to current situation. In: Journal of food science. Band 75, Nummer 3, April 2010, S. R71–R76, doi:10.1111/j.1750-3841.2010.01529.x, PMID 20492309.
- ↑ Franz von Bruchhausen: Hagers Handbuch der Pharmazeutischen Praxis. Springer-Verlag, 1938, ISBN 978-3-540-52688-9, S. 67.
