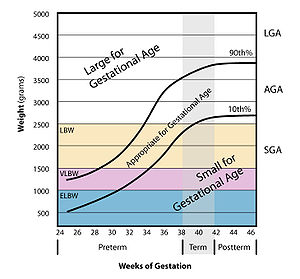
Small for Gestational Age
Small for Gestational Age (englisch für ‚klein bezogen auf das Reifealter‘), abgekürzt SGA, ist eine international gebräuchliche medizinische Bezeichnung. In Ermangelung einer griffigen deutschen Entsprechung setzt sie sich auch im deutschen Sprachraum immer mehr durch. Sie beschreibt untergewichtige oder zu kleine Neugeborene, bei denen das Geburtsgewicht oder die Körperlänge bezogen auf das Reifealter im unteren Bereich der statistischen Normalverteilung liegt.
Definition und Einteilung
Es sind zwei verschiedene Definitionen gebräuchlich. Bei der einen liegt das Geburtsgewicht beziehungsweise die Länge mindestens zwei Standardabweichungen unterhalb des Mittelwertes. Diese wird von Ärzten bevorzugt, die sich speziell mit Wachstum und der Langzeitentwicklung dieser Kinder beschäftigen. Vorwiegend Neugeborenenmediziner (Neonatologen) definieren SGA unterhalb des zehnten Prozentrangs (Perzentile) der bevölkerungsbezogenen Wachstumskurve.[1] In der Mehrzahl der Fälle tritt die Verlangsamung des Wachstums erst im letzten Drittel der Schwangerschaft ein und es bleibt im Wesentlichen das Gewicht zurück, wohingegen sich Länge und Kopfumfang noch normal entwickeln. Dann spricht man von einer asymmetrischen Retardierung. Sind jedoch sowohl Gewicht als auch Länge und Kopfumfang betroffen, handelt es sich um eine symmetrische Retardierung. Da diese Definition eine rein statistische ist, sagt sie nichts über die Ursachen aus.
Der Begriff der intrauterinen Wachstumsretardierung, englisch intrauterine growth restriction (IUGR) wird zwar häufig synonym zu SGA verwendet, stellt aber streng genommen nur diejenige Gruppe innerhalb aller SGA-Kinder dar, bei denen der Kleinwuchs durch eine krankhafte Störung zu erklären ist. Anders ausgedrückt sind alle Neugeborenen mit einer intrauterinen Wachstumsretardierung auch Small for Gestational Age, aber nur bei einem Teil der SGA-Kinder besteht eine IUGR.
Häufigkeit
Da die engere Definition von SGA rechnerisch einem Gewicht oder einer Länge in etwa unterhalb der 3. Perzentile (−1,88 SD) entspricht, wäre die Häufigkeit eigentlich mit etwa drei Prozent der Kinder zu erwarten. Es fallen sowohl Kinder, die zu leicht, aber normal groß, als auch Kinder, die zu klein, aber normalgewichtig sind, darunter. Daher liegt die tatsächliche Häufigkeit mit fünf Prozent aller Neugeborenen etwas höher.[1] Bezogen auf eine Geburtenzahl von derzeit etwa 700.000/Jahr sind in Deutschland etwa 35.000 Neugeborene eines Jahrgangs davon betroffen.
Ursachen
Zum einen ist in der Gruppe der SGA-Kinder der Teil gesunder Neugeborener enthalten, der im Rahmen der statistischen Normalverteilung das untere Ende der Glockenkurve ausmacht. Dazu kommen aber auch diejenigen Kinder, deren Wachstum im Mutterleib verzögert ist. Dieser Sachverhalt wird in der Literatur auch als Intrauterine Wachstumsverzögerung, englisch intrauterine growth restriction (IUGR) bezeichnet.
Mütterliche Risikofaktoren
Die Ursache der häufigeren asymmetrischen Retardierung ist zumeist in einer Unterversorgung des Feten mit Nährstoffen und Sauerstoff aufgrund einer eingeschränkten Kapazität des Mutterkuchens (Plazenta) zu suchen. Diese wiederum ist mit etwa 40 % weitaus am häufigsten auf einen mütterlichen Zigarettenkonsum zurückzuführen.[2] Ein weiterer häufiger negativer Einflussfaktor auf die Gewichtsentwicklung des Ungeborenen stellt ein in der Schwangerschaft neu aufgetretener und durch diese hervorgerufener (schwangerschaftsinduzierter) erhöhter Blutdruck (Gestationshypertonie) dar. Andere chronische Erkrankungen wie Herzfehler, Diabetes mellitus, chronische Infektionen (AIDS, Malaria, Tuberkulose), Lungenerkrankungen, Nierenerkrankungen, Magen-Darm-Erkrankungen, Anämien können genauso wie Fehlbildungen der Gebärmutter ebenfalls zu einer verminderten Funktion der Plazenta mit Wachstumsstörung führen, sind aber deutlich seltener. Die Behebung eines Eisenmangels und die Verhinderung einer dadurch ausgelösten Anämie konnte laut einer neuen Metaanalyse von insgesamt 92 Studien die Zahl der SGA-Geburten reduzieren[3].
Fetale Risikofaktoren
Relativ selten führen Anomalien bei Feten zu einer – dann meist symmetrischen – Wachstumsverzögerung.[2] Neben Veränderungen an den Erbanlagen (chromosomale Störungen) wie der Trisomie 21 können auch alle angeborenen Fehlbildungen von Organen mit einem verminderten Wachstum einhergehen. Seltene Infektionen des Fetus in der Schwangerschaft, wie beispielsweise Röteln, Zytomegalie, Toxoplasmose, Syphilis oder Listeriose, führen nicht nur zu einem Untergewicht, sondern häufig auch zu schwerwiegenden Fehlbildungen.
Risikofaktoren seitens des Mutterkuchens
Zu den Störungen im Aufbau und der Struktur der Plazenta selbst, die ursächlich für eine beeinträchtigte Gewichtsentwicklung sein können, gehören beispielsweise eine fehlerhafte Einmündung der Nabelschnur (Insertio velamentosa), ein vor dem Muttermund liegender Mutterkuchen (Placenta praevia), das Vorliegen einer einzelnen Nabelschnurarterie (Singuläre Umbilikalarterie) oder Infarkte des Mutterkuchens. Ob die erhöhte Häufigkeit von untergewichtigen Mehrlingskindern eher eine räumliche Begrenzung der Plazenta oder die notwendige Aufteilung des mütterlichen Nahrungsangebotes zur Ursache hat, ist noch nicht eindeutig geklärt.[2]
Risiken und Langzeitprognose
Bis zu einem Drittel der untergewichtigen Kinder kommen zu früh auf die Welt und tragen so das Risiko der Frühgeburtlichkeit.[2] Nach der Geburt kommt es gehäuft zu Unterzuckerungen (Hypoglykämie) und zu erniedrigten Calcium-Konzentrationen im Blut (Hypocalcämie). Einen vorbestehenden Sauerstoffmangel versucht der Organismus durch Bereitstellung vermehrter roter Blutkörperchen zu kompensieren, was zu einer Polyglobulie mit erhöhter Zähflüssigkeit (Viskosität) des Blutes und entsprechenden Durchblutungsstörungen führen kann. Schwerwiegende Schädigungen des Gehirns mit Lähmungen oder Bewegungsstörungen treten nur wenig häufiger als bei normalgewichtigen Kindern auf. Wohl sind aber im Grundschulalter feinere neurologische Auffälligkeiten wie Bewegungs- und Koordinationsstörungen oder Störungen der Feinmotorik etwas öfter vertreten.[2] Obwohl etwa 80 % der zu kleinen Kinder schon im ersten Lebenshalbjahr ein Aufholwachstum entwickeln und im Alter von sechs Monaten schon eine normale Länge aufweisen, besteht für ungefähr die Hälfte der übrigen 20 % der Betroffenen das Risiko, kleinwüchsig zu bleiben. Besteht der Kleinwuchs bis zum zweiten Geburtstag fort, ist es sehr unwahrscheinlich, dass er sich im Laufe des weiteren Wachstums noch ausgleicht.[1] Darüber hinaus weisen untergewichtige Neugeborene später gehäuft eine Insulinresistenz, einen Diabetes mellitus Typ 2, hohen Blutdruck und erhöhte Blutfettwerte, zusammenfassend also ein metabolisches Syndrom auf. Dies drückt sich auch in einer erhöhten Sterblichkeitsrate an Herz-Kreislauf-Erkrankungen im Erwachsenenalter aus.[1]
Behandlung
Da das Aufholwachstum im ersten Lebensjahr ernährungsabhängig ist, muss besonders auf eine ausreichende Ernährung geachtet werden. Ob ein ausreichendes Aufholwachstum einsetzt, kann nur durch frühzeitige engmaschige Kontrollen der Längen- und Gewichtsentwicklung beurteilt werden. Bleibt ein Kind bis zum zweiten Geburtstag mehr als zwei Standardabweichungen unter dem Mittelwert zurück, müssen andere Grunderkrankungen für den Kleinwuchs ausgeschlossen werden. Vom Alter von vier Jahren an kann eine Behandlung mit Wachstumshormon begonnen werden. Die meisten Kinder erreichen dadurch nach etwa drei Jahren eine Länge innerhalb der statistischen Normalverteilung.[1] Es wird allerdings empfohlen, die Therapie bis zum Erreichen der Endgröße fortzusetzen, da sich die Wachstumsgeschwindigkeit bei Unterbrechung deutlich verringert und auf diese Weise wieder ein Längendefizit eintreten kann.
Einzelnachweise
- ↑ a b c d e H. A. Wollmann: Zu klein bei Geburt (SGA). In: Monatsschrift Kinderheilkunde 152, 2004, S. 528–535.
- ↑ a b c d e H. A. Wollmann: Intrauterine Wachstumsretardierung. In: Monatsschrift Kinderheilkunde 146, 1998, S. 714–726.
- ↑ B. A. Haider, I. Olofin, M. Wang, D. Spiegelman, M. Ezzati, W. W. Fawzi: Anaemia, prenatal iron use, and risk of adverse pregnancy outcomes: systematic review and meta-analysis. In: BMJ. 346, 2013, S. f3443–f3443, doi:10.1136/bmj.f3443.