Kaliumhexafluoroantimonat(V)
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
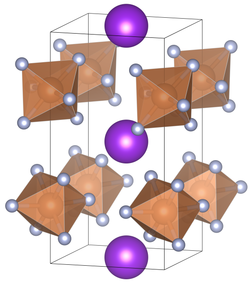
| ||||||||||||||||
| _ K+ _ Sb5+ _ F− | ||||||||||||||||
| Kristallsystem |
tetragonal | |||||||||||||||
| Raumgruppe |
P42m (Nr. 111) | |||||||||||||||
| Gitterparameter |
a = 5,16 Å, c = 10,07 Å[1] | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kaliumhexafluoroantimonat(V) | |||||||||||||||
| Verhältnisformel | K[SbF6] | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 274,85 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt |
846 °C[4] | |||||||||||||||
| Siedepunkt |
1505 °C[4] | |||||||||||||||
| Löslichkeit |
löslich in Wasser[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Kaliumhexafluoroantimonat, K[SbF6] ist eine anorganische Verbindung zwischen dem Alkalimetall Kalium und der Supersäure Hexafluorantimonsäure.
Gewinnung und Darstellung
Kaliumhexafluoroantimonat kann durch Reaktion von Kaliumpyroantimonat K2H2Sb2O7 mit Fluorwasserstoff oder durch Behandlung des Produkts der Reaktion einer Mischung aus festem Antimon(III)-oxid und Kaliumhydroxid mit Wasserstoffperoxid-Lösung (30 %) mit Salzsäure (48 %) dargestellt werden. Die Verbindung kann auch durch Behandlung einer äquimolaren Mischung aus Antimon(V)-chlorid und Kaliumchlorid (oder Kaliumfluorid) mit einem Überschuss an wasserfreiem Fluorwasserstoff bei hohen Temperaturen und Drücken synthetisiert werden.[6]
Eigenschaften
Kaliumhexafluoroantimonat ist ein geruchsloses, weißes Pulver. Es lässt sich in Wasser lösen.[3][5] Kaliumhexafluoroantimonat kristallisiert in Abhängigkeit von der Temperatur in einer tetragonalen (Koordinationszahl der A-Position = 8) mit der Raumgruppe P42m (Raumgruppen-Nr. 111)[1] und einer kubischen (Koordinationszahl der A-Position = 6) Variante mit der Raumgruppe Ia3 (Raumgruppen-Nr. 206).[7][8] Die Verbindung unterzieht sich bei 16 °C einem Übergang von einer kubischen zur tetragonalen Kristallstruktur.[6] Bei hohem Druck ist eine weitere Kristallstruktur bekannt.[9]
Verwendung
Kaliumhexafluoroantimonat wird als pharmazeutisches Zwischenprodukt verwendet.[5]
Sicherheitshinweise
Die Verbindung wirkt beim Verschlucken oder Inhalieren giftig.[3]
Das Salz kann heftige Reaktionen mit starken Säuren und Oxidationsmitteln hervorrufen.[3][4] Bei der Verbrennung des Stoffes kann Fluorwasserstoff, Kaliumoxid und Antimonoxide entstehen.[2][4][5]
Einzelnachweise
- ↑ a b G. J. Kruger, C. W. F. T. Pistorius, A. M. Heyns: Potassium hexafluoroantimonate (I). In: Acta Crystallographica Section B. B32, 1976, S. 2916–2918, doi:10.1107/S0567740876009230 (Open Access).
- ↑ a b Datenblatt Potassium hexafluoroantimonate bei ApolloScientific, abgerufen am 16. Februar 2019 (PDF).
- ↑ a b c d Datenblatt Potassium hexafluoroantimonate(V) bei Sigma-Aldrich, abgerufen am 16. Februar 2019 (PDF).
- ↑ a b c d Datenblatt Potassium hexafluoroantimonate(V) bei Santa Cruz Biotechnology, abgerufen am 16. Februar 2019 (PDF).
- ↑ a b c d e f Datenblatt Potassium hexafluoroantimonate bei AlfaAesar, abgerufen am 16. Februar 2019 (PDF) (JavaScript erforderlich).
- ↑ a b Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 978-0-412-30120-9, S. 3217 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Caroline Röhr, Rüdiger Kniep: Die Kristallstrukturen von Li[PF6] und Li[AsF6]: Zur Kristallchemie von Verbindungen A[EVF6]. In: Zeitschrift für Naturforschung B. 49, 1994, S. 650–654 (PDF, freier Volltext).
- ↑ Hans Bode, Ernst Voss: Die Kristallstruktur des Kaliumhexafluoroantimonats (V). In: Zeitschrift für anorganische und allgemeine Chemie. Band 264, Nr. 2–4, März 1951, S. 144–150, doi:10.1002/zaac.19512640208.
- ↑ Anton M. Heyns, Carl W. F. T. Pistorius: Polymorphism, high-pressure phase diagram and vibrational spectra of KSbF6. In: Spectrochimica Acta Part A. Band 32, Nr. 3, 1976, S. 535–545, doi:10.1016/0584-8539(76)80114-6.

