Lithiumchloracetat
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
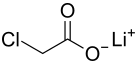
| ||||||||||
| Allgemeines | ||||||||||
| Name | Lithiumchloracetat | |||||||||
| Summenformel | C2H2ClLiO2 | |||||||||
| Kurzbeschreibung | ||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 100,43 g·cm−3 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Thermodynamische Eigenschaften | ||||||||||
| ΔHf0 |
−815,95 kJ·mol−1.[4] | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Lithiumchloracetat ist das Lithiumsalz der Chloressigsäure mit der Summenformel C2H2ClO2Li.
Gewinnung und Darstellung
Lithiumchloracetat kann durch Salzbildungsreaktion aus Lithiumhydroxid und Chloressigsäure in Methanol[1] oder Ethanol[5] hergestellt werden.
Eine Synthese aus Lithiumhydrid und Chloressigsäure in THF wurde ebenfalls beschrieben.[2]
Eigenschaften
Lithiumchloracetat kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21/c (Raumgruppen-Nr. 14) mit den Gitterparametern a = 938,8 pm, b = 484,5 pm, c = 901,2 pm und β = 94,33°. In der Elementarzelle befinden sich vier Formeleinheiten.[6] Die Kristalle sind isomorph zu Lithiumbromacetat und Lithiumiodacetat.[6]
Im Gegensatz zu vielen anderen Halogenacetaten der Alkalimetalle geht Lithiumchloracetat im festen Zustand keine Polymerisationsreaktion zu Poly-hydroxyessigsäure ein.[6]
Lithiumchloracetat zerfällt beim Erhitzen an der Luft in Lithiumchlorid, Kohlendioxid und Wasser.[4]
Einzelnachweise
- ↑ a b Patentanmeldung CA1339748: Glycolate Ester Peracid Precursors. Angemeldet am 28. Oktober 1987, veröffentlicht am 17. März 1998, Anmelder: Clorox, Erfinder: R. A. Fong, S. N. Lewis, R. J. Wiersema, A. G. Zielske.
- ↑ a b E. Homberger-Zizzari: Porphobilinogene Synthase (PBGS) d'Escherichia Coli: Etudes cinetiques et rayons X, Deux outils permettant la caracterisation du site actif et la determination du mecanisme enzymatique. Dissertation 2002. Université de Fribourg (Volltext).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b O. Herzberg: Untersuchung organischer Festkörperreaktionen am Beispiel von Substitutions- und Polykondensationsreaktionen. Hamburg 2000, DNB 960245774, urn:nbn:de:gbv:18-2380 (Dissertation, Universität Hamburg).
- ↑ M. Epple, O. Herzberg: Polyglycolide with controlled porosity: an improved biomaterial. In: Journal of Materials Chemistry. Band 7, Nr. 6, 1997, S. 1037–1042, doi:10.1039/A700275K.
- ↑ a b c H. Ehrenberg, B. Hasse, K. Schwarz, M. Epple: Structure determination of lithium chloroacetate, lithium bromoacetate and lithium iodoacetate by powder diffraction. In: Acta Crystallographica Section B Structural Science. Band 55, Nr. 4, 1999, S. 517–524, doi:10.1107/S0108768199003614.
