Xanthin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Xanthin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C5H4N4O2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 152,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
sehr wenig wasserlöslich (69 mg·l−1 bei 16 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Xanthin ist eine natürlich vorkommende Substanz des Nukleotidstoffwechsels. Sie ist Zwischenprodukt beim Purinabbau und wird durch die Xanthinoxidase in Harnsäure umgewandelt. Darüber hinaus ist Xanthin die Leitsubstanz der Gruppe der Xanthine, zu denen die Purinalkaloide Coffein, Theobromin und Theophyllin aus Teeblättern, Kaffeebohnen, Kakao, Kolanüssen, Mate und Guaraná gehören.
Vorkommen
Xanthin ist ein Zwischenprodukt des Purinabbaus durch Hydroxylierung an den Positionen 2 und 6; das entstehende Dilactim tautomerisiert vollständig zum Dilactam. Es entsteht z. B. im Wein in geringen Mengen durch die Selbstverdauung von Hefen. Auch in Kaffeebohnen, Kartoffeln, Teeblättern[5] und Mate, dem argentinischen Nationalgetränk, kommt es vor. Dort wird ihm eine anregende Wirkung nachgesagt. Im menschlichen Körper enthalten einige Organe wie Blut, Muskeln und Leber Xanthin, das auch über den Urin ausgeschieden wird.
Eigenschaften
Xanthin ist ein farbloser, kristalliner Feststoff, der sich gut in Essigsäureethylester[5], Säuren und Basen[2], sehr wenig (69 mg·l−1)[3] in 16 °C kaltem Wasser und nur mäßig in heißem Wasser und Ethanol löst.[2]
Vom Xanthin leiten sich das Nukleosid Xanthosin und das Nukleotid Xanthosinmonophosphat ab.
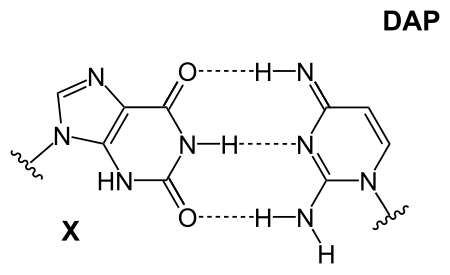
Es wird zusammen mit 2,4-Diaminopyrimidin zur Untersuchung von ungewöhnlichen Basenpaarungen in der DNA herangezogen.[6]
Pathophysiologie
Xanthinsteine als eine Form der Harnsteine treten relativ selten auf. Sie können bei einer Xanthinurie vorkommen. Die Ursache dieser gar nicht so seltenen Erkrankung ist ein genetisch bedingter Defekt der Xanthinoxidase. Da Xanthin medizinisch gesehen relativ gut wasserlöslich ist, treten nur bei etwa 40 % der Betroffenen Harnsteine auf. Eine Xanthinurie kann auch bei Behandlung mit Allopurinol auftreten. Allopurinol hemmt die Xanthinoxidase und wird als Medikament zur Senkung des Serum-Harnsäurespiegels (vor allem bei Gicht-Patienten) eingesetzt. Bei zu geringer Flüssigkeitszufuhr kann im Harn eine für eine Steinbildung kritische Xanthin-Konzentration erreicht werden.
Einzelnachweise
- ↑ Eintrag zu XANTHINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 29. März 2020.
- ↑ a b c d Eintrag zu Xanthin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 24. Mai 2012.
- ↑ a b c Eintrag zu Xanthine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 27. Februar 2021.
- ↑ a b Datenblatt Xanthine bei Sigma-Aldrich, abgerufen am 25. April 2011 (PDF).
- ↑ a b Ammon, H. P. T.: Hunnius pharmazeutisches Wörterbuch, Walter de Gruyter, 2004, ISBN 3-11-017487-1, S. 1623.
- ↑ S. T. Madariaga, J. G. Contreras: „Tautomerism of xanthine and its pairing with 2,6-diaminopyrimidine: An ab initio study in the gas phase and aqueous solution“, J. Chil. Chem. Soc., 2003, 48 (4), S. 129–133 (doi:10.4067/S0717-97072003000400021).
Weblinks
- Eintrag zu Xanthine in der Human Metabolome Database (HMDB), abgerufen am 3. November 2013.