Kongenitales Megakolon
| Klassifikation nach ICD-10 | |
|---|---|
| Q43.1 | Hirschsprung-Krankheit |
| ICD-10 online (WHO-Version 2019) | |
Beim kongenitalen Megakolon (Synonym Megacolon congenitum, angeborenes Megakolon, aganglionotisches Megakolon, Hirschsprung-Krankheit, Morbus Hirschsprung oder Hirschsprungsche Krankheit) handelt es sich um eine angeborene Erkrankung des Dickdarms aus der Gruppe der Aganglionosen. Dabei fehlen in einem Abschnitt des Dickdarms Nervenzellen, wodurch sich die dortige Muskulatur zusammenzieht und den Darm verengt. Der Stuhl staut sich vor der Engstelle, wodurch sich der davorliegende Teil des Darms erweitert (dilatiert).
Erwähnt wurde diese Krankheit erstmals 1691 von dem niederländischen Mediziner Frederik Ruysch.[1]
Name und Häufigkeit
Systematischer Erstbeschreiber (1886) ist der dänische Pädiater Harald Hirschsprung (1830–1916).
Im Durchschnitt tritt diese Fehlbildung bei 1 von 5000 Kindern auf, wobei Jungen im Vergleich deutlich häufiger betroffen sind als Mädchen. Bei ca. 12 % der Säuglinge mit einem Down-Syndrom (Trisomie 21) ist Morbus Hirschsprung nachweisbar. Kombinationen mit anderen Fehlbildungen (z. B. Mukoviszidose, Brachydaktylie, Kolonatresie) kommen vor, sind aber selten.
In 80 % der Fälle sind bei der Aganglionose nur das Rektum und/oder Sigma betroffen (Short-Segment-Aganglionose). Etwa 5 % gehören zur Long-Segment-Aganglionose, bei der der krankhaft veränderte Dickdarmabschnitt insgesamt 40 cm und mehr ausgedehnt ist. In weniger als 5 % der Fälle fehlen die Nervenzellen im gesamten Abschnitt des Dickdarmes, man spricht in diesem Fall von einem Jirásek-Zuelzer-Wilson-Syndrom. In einigen Fällen fehlen die Nervenzellen bis in den Dünndarm.
Das kongenitale Megakolon kann auch im Rahmen von Syndromen auftreten, siehe Mowat-Wilson-Syndrom.
Ursachen
Ein Mangel an Ganglienzellen (Aganglionose) im Bereich des Plexus submucosus (Meißner-Plexus) bzw. myentericus (Auerbach-Plexus) führt zu einer Hyperplasie (übermäßige Zellbildung) der vorgeschalteten parasympathischen Nervenfasern mit vermehrter Acetylcholin-Ausschüttung. Durch diese permanente Stimulation der Ringmuskulatur kommt es zu einem dauerhaften Zusammenziehen des betroffenen Darmabschnittes. Das übermäßig gebildete Acetylcholin wird durch eine als Ausgleich vermehrt produzierte Acetylcholinesterase abgebaut.
Späte Defekte der Neuroblasteneinwanderung, Reifungsstörungen eingewanderter Neuroblasten, zeitweilige Ischämien (Minderdurchblutung) des Darms oder virale Infektionen beim Embryo kommen als Ursache in Frage. Bei Untersuchungen zum Morbus Hirschsprung wurden Mutationen im sogenannten Ret-Protoonkogen (autosomal dominante Form), im Endothelin-3-Gen (EDN3) und im Endothelinrezeptor-Gen (EDNRB) (autosomal rezessive Form) belegt.
Die Multiple endokrine Neoplasie Typ IIa kann mit der Symptomatik des M. Hirschsprung im Zusammenhang stehen. Auch dort liegt eine Mutation des Ret-Protoonkogens vor.[2]
Da die Krankheit bei Heiraten unter Verwandten häufiger vorkommt, ist sie bei den Amischen (USA) überdurchschnittlich verbreitet.
Auswirkung
Die Ringmuskulatur wird übererregt und zieht sich zusammen – das betroffene Darmsegment, meist das Rektum, wird eingeengt. Dadurch entsteht ein Darmverschluss. Der Darm kann nicht mehr regelgerecht entleert werden, wodurch eine schwere Verstopfung entsteht. Durch Kotstauung im Dickdarm erweitert sich dann vor dem verengten Segment das Darmvolumen und es kommt zum Megacolon. Dies wiederum führt zu Beschwerden wie Meteorismus und Erbrechen. Durch die Ansammlung von Kot kann es zu einer Stuhlinkontinenz im Sinne einer Überlaufenkopresis kommen. Bei etwa 15 % der Patienten weist das Megacolon unterschiedlich schwere und teilweise auch Entzündungen mit einhergehendem Absterben von Gewebszellen durch Clostridium-Bakterien auf.
Klinische Zeichen
Erste Hinweise geben die genannten Beschwerden, die in der Regel innerhalb der ersten Tage nach der Geburt auffallen. Fehlender Mekoniumabgang (Kindspech) oder ein Mekonium-Darmverschluss (ansonsten typisch für Mukoviszidose) können auf Morbus Hirschsprung hinweisen.
Bei der rektalen Untersuchung zeigt sich ein leerer Mastdarm sowie ein enger Analkanal.
Bei Erwachsenen tritt Morbus Hirschsprung selten auf und fällt durch chronische Verstopfung auf. Der Darmabschnitt, in dem Nervenzellen fehlen, ist hier meist sehr kurz, weshalb die Diagnose eines Morbus Hirschsprung erst spät gestellt wird.
Diagnostik
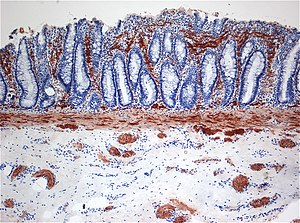
Die Verdachts-Diagnose ergibt sich aus dem gesamten Beschwerdebild des Patienten bzw. dem klinischen Bild, gegebenenfalls unterstützt durch eine anorektale (im Bereich zwischen Anus und Rektum) Manometrie. Zur Diagnosesicherung ist eine Serien-Saugbiopsie aus der Mastdarmschleimhaut unter Vollnarkose oder in Sedierung erforderlich. Bei ausreichender Biopsietiefe kann die pathologische Untersuchung in der NADH-Reaktion das Fehlen von Ganglienzellen bestätigen.
Radiologische Diagnostik mittels eines Kolon-Kontrastmitteleinlaufs ist in aller Regel nicht definitiv aussagekräftig, lediglich die mutmaßliche Ausdehnung der Veränderungen, wichtig für die Planung der Serienbiopsien, kann geschätzt werden. Enzymhistochemisch lässt sich anhand der Acetylcholinesterase-Aktivität nach den ersten Lebensmonaten eine cholinerge Fehlinnervation oberer Schleimhautschichten (Lamina propria) nachweisen.[3] Diagnostisch hilfreich kann auch das Fehlen des in Ganglienzellen exprimierten Proteins Calretinin in der Immunhistochemie sein.[4][5]
Behandlung
Bei Neugeborenen wird bis zu einem operativen Eingriff meist vorübergehend ein künstlicher Darmausgang angelegt oder der Darm regelmäßig nach Anleitung gespült bzw. mit einem Darmrohr so gut wie möglich geleert. Dieses wird in den After eingeschoben. Das Darmrohr wird derzeit aber immer seltener verwendet. Als Therapie wird der betroffene Darmabschnitt operativ entfernt, bei sehr kurzem aganglionären Segment kann auch der dauerkontrahierte Schließmuskel eingeschnitten werden (Sphinktermyektomie). Für die Operation eignen sich offene Eingriffe, die Laparoskopische Chirurgie und die Transanale Endoskopische Mikrochirurgie. Vier Verfahren wurden bekannt:
- Orvar Swensson, Chicago (1948)
- Fritz Rehbein, Bremen (1953)
- Bernard Duhamel, Paris (1964)
- Franco Soave, Genua (1964)
Komplikationen
Bei unbehandeltem M. Hirschsprung kann als entzündliche Komplikation eine Enterokolitis auftreten, in deren Rahmen es unter anderem zu einer Peritonitis und Sepsis kommen kann.
Literatur
- Leitlinie zur Aganglionose (Morbus Hirschsprung). Deutsche Gesellschaft für Kinderchirurgie
- M. Garcia-Barcelo, M. H. Sham, W. S. Lee, V. C. Lui, B. L. Chen, K. K. Wong, J. S. Wong, P. K. Tam: Highly recurrent RET mutations and novel mutations in genes of the receptor tyrosine kinase and endothelin receptor B pathways in Chinese patients with sporadic Hirschsprung disease. In: Clin Chem., 2004 Jan, 50(1), S. 93–100. PMID 14633923, Volltext
Weblinks
- Morbus Hirschsprung: Uniklinik Jena sehr verständliche, gut illustrierte Beschreibung (Uniklinik Jena)
- Minimal invasive Darmresektion oder die Chirurgie des Morbus Hirschsprung im Wandel der Zeit. KidsDoc.at
Einzelnachweise
- ↑ Gerald Neitzke: Hirschsprung-Krankheit. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 603.
- ↑ Wohllk u. a.: Multiple endocrine neoplasia type 2. In: Best Practice & Research Clinical Endocrinology & Metabolism, 2010 Jun; 24(3), S. 371–387. PMID 20833330
- ↑ Meier-Ruge u. a.: Acetylcholinesterase activity in suction biopsies of the rectum in the diagnosis of Hirschsprung’s disease. In: J Pediatr Surg., 1972; 7(1), S. 11–17. PMID 5013118
- ↑ Barshack u. a.: The loss of calretinin expression indicates aganglionosis in Hirschsprung’s disease. In: J Clin Pathol., 2004; 57, S. 712–716. PMID 15220363
- ↑ Guinard-Samuel u. a.: Calretinin immunohistochemistry: a simple and efficient tool to diagnose Hirschsprung disease. In: Mod Pathol., 2009; 22, S. 1379–1384. PMID 19648883