N-Methylethanolamin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
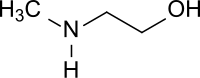
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | N-Methylethanolamin | ||||||||||||
| Andere Namen | |||||||||||||
| Summenformel | C3H9NO | ||||||||||||
| Kurzbeschreibung |
farblose bis leicht gelbliche Flüssigkeit mit aminartigem Geruch[2] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 75,11 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||
| Dichte |
0,94 g·cm−3 (20 °C)[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
160 °C[2] | ||||||||||||
| Dampfdruck | |||||||||||||
| Löslichkeit | |||||||||||||
| Brechungsindex |
1,4390 (20 °C)[3] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
N-Methylethanolamin (NMEA, auch 2-Methylaminoethanol) ist sowohl ein einwertiger, primärer Alkohol als auch ein sekundäres Amin und stellt einen bifunktionellen Synthesebaustein für eine Vielzahl von Folgeprodukten dar. NMEA ist eine farblose Flüssigkeit, die aminartig riecht und in Wasser basisch reagiert.
Herstellung
N-Methylethanolamin wird großtechnisch durch Umsetzung von Ethylenoxid mit überschüssigem Methylamin in wässriger Lösung hergestellt. Dabei entsteht ein Gemisch aus dem 1:1-Additionsprodukt NMEA (1) und – durch weitere Addition einer EO-Einheit – dem 1:2-Additionsprodukt Methyldiethanolamin (MDEA) (2):
Zur Erzielung hoher Ausbeuten am erwünschten Zielprodukt NMEA werden die Reaktanden mit einem mehr als zweifachen Überschuss an Methylamin unter exakter Einhaltung von Druck und Temperatur kontinuierlich einem Durchflussreaktor zugeführt und zur Reaktion gebracht.[5] In nachgelagerten Prozessschritten wird das überschüssige Methylamin und das Wasser entfernt und das Produktgemisch durch fraktionierte Destillation in NMEA (Sdp. 160 °C) und MDEA (Sdp. 243 °C) aufgetrennt. Die durch weitere Addition von Ethylenoxid an die gebildeten Methylethanolamine entstehenden Poly-[methyl-ethanolamine] verbleiben im Destillationssumpf.
Eigenschaften
N-Methylethanolamin ist eine klare, farblose, hygroskopische, aminartig riechende Flüssigkeit, die in jedem Verhältnis mit Wasser und Ethanol mischbar ist und in wässriger Lösung stark basisch reagiert (pH-Wert 13,6 bei 100 g·l−1 (20 °C)) und daher ätzend und korrosiv wirkt. Die Substanz ist leicht bioabbaubar und besitzt wegen ihrer Wassermischbarkeit kein Bioakkumulationspotential. NMEA ist nicht mutagen, in Gegenwart von Nitrit können aber aus NMEA als sekundärem Amin karzinogene Nitrosamine gebildet werden.[6] Die Wassergefährdungsklasse ist 1 – schwach wassergefährdend. Der Flammpunkt liegt bei 74 °C, die Zündtemperatur bei 350 °C und die Explosionsgrenzen zwischen 1,5 Vol.-% (untere Explosionsgrenze) und 11,7 Vol.-% (obere Explosionsgrenze).[2]
Verwendung
N-Methylethanolamin wird wie andere Alkylalkanolamine in wasser- und lösemittelbasierten Anstrichen und Beschichtungen als Lösungsvermittler für andere Komponenten, wie z. B. Pigmente und als Stabilisator eingesetzt.
In der kathodischen Tauchlackierung dient NMEA als bei der Teilneutralisation kationischer Dispergator für das Epoxidharz und als Kettenverlängerer bei der Reaktion von hochmolekularen Polyepoxiden mit Polyolen.
NMEA bildet als Base mit Fettsäuren neutrale Salze, die oberflächenaktive Seifen mit guten Emulgatoreigenschaften darstellen und Anwendungen in Textil- und Körperpflegereinigungsprodukten finden. Bei der Bleichung von Baumwolle-Polyester-Mischgeweben wird NMEA als Aufheller genutzt.[3]
Durch Methylierung von N-Methylaminoethanol sind Dimethylaminoethanol und Cholin [(2-Hydroxyethyl)-trimethyl-ammoniumchlorid] zugänglich.
Bei der Umsetzung von NMEA mit Fettsäuren entstehen unter Wasserabspaltung langkettige N-Methyl-N-(2-hydroxyethyl)amide, die als neutrale Tenside eingesetzt werden. Solche Amide wirken auch als Fließverbesserer und Stockpunkt-Erniedriger (engl. pour point depressant) in Schwerölen und Mitteldestillaten.[7]
Durch katalytische Oxidation von NMEA wird die nicht-proteinogene Aminosäure Sarcosin erhalten.[8]
N-Methylaminoethanol spielt als Baustein für die Synthese von Pflanzenschutz- und Arzneimitteln eine Rolle, wie z. B. in der ersten Stufe der Reaktionssequenz zum Antihistaminikum und Antidepressivum Mianserin (Tolvin®) und zum nicht-opioden Analgetikum Nefopam (Ajan®).[9]
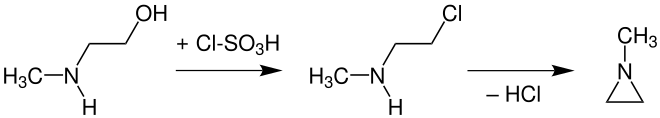
In Analogie zum Aziridin kann N-Methylaziridin durch eine Wenker-Synthese aus NMEA über den Schwefelsäureester oder nach Austausch der Hydroxygruppe durch ein Chloratom,
z. B. mittels Thionylchlorid oder Chlorsulfonsäure[10] zum N-Methyl-2-chlorethylamin mithilfe einer starken Base (Abspaltung von HCl) in einer intramolekularen nukleophilen Substitution erhalten werden.
Verwandte Verbindungen
Einzelnachweise
- ↑ Eintrag zu METHYLETHANOLAMINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 23. Oktober 2021.
- ↑ a b c d e f g h i j k Eintrag zu 2-Methylaminoethanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b The Dow Chemical Company: Alkyl Alkanolamines, März 2003.
- ↑ Eintrag zu 2-methylaminoethanol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Miura Trading & Finvest Pvt. Ltd.: Methyl Ethanolamines Technology (Memento vom 6. März 2016 im Internet Archive) (PDF; 152 kB).
- ↑ Product Safety Assessment, DOWTM N-Methylethanolamine, The Dow Chemical Company, Version vom 24. März 2010.
- ↑ Patent USRE30238E: Additives to improve the flow of heavy fuels and crude oils. Angemeldet am 25. September 1978, veröffentlicht am 25. März 1980, Anmelder: Rohm and Haas Co, Erfinder: Edward H. Specht, James H. O'Mara.
- ↑ Patent US8227638B2: Process for preparing creatine, creatine monohydrate or guanidinoacetic acid. Angemeldet am 5. April 2007, veröffentlicht am 24. Juli 2012, Anmelder: Alzchem Trostberg GmbH, Erfinder: Franz Thalhammer, Thomas Gastner.
- ↑ A. Kleemann u. J. Engel, Pharmazeutische Wirkstoffe: Synthese, Patente, Anwendungen, 2. überarb. u. erw. Aufl., Georg Thieme Verlag, Stuttgart, New York, 1982, ISBN 3-13-558402-X.
- ↑ J.H. Drese, The design, synthesis, and characterization of aminosilica adsorbants for CO2 capture from dilute sources (PDF; 5,3 MB), Ph.D. Thesis, Georgia Institute of Technology, Dezember 2010, S. 175.