Natriumhyperoxid
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
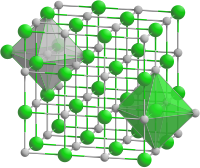
| ||||||||||
| _ Na+ _ O2− | ||||||||||
| Allgemeines | ||||||||||
| Name | Natriumhyperoxid | |||||||||
| Andere Namen |
| |||||||||
| Verhältnisformel | NaO2 | |||||||||
| Kurzbeschreibung |
leicht zersetzlicher gelber Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 54,99 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
2,2 g·cm−3 [2] | |||||||||
| Schmelzpunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Natriumhyperoxid ist eine chemische Verbindung mit der Formel NaO2 aus der Gruppe der Hyperoxide.
Darstellung und Vorkommen
Es entsteht bei der Umsetzung von Natriumperoxid mit Sauerstoff bei hohen Temperaturen und Drücken[5] (z. B. bei Eintritt von Meteoriten in die Erdatmosphäre) und kommt in einigen Mineralien vor.
Eigenschaften
Natriumhyperoxid zersetzt sich bei Kontakt mit Wasser (Hydrolyse) zu Natriumhydroxid und Sauerstoff und/oder Wasserstoffperoxid:
Es tritt in drei Kristallstrukturen auf (trimorph): Unter −77 °C in Markasitstruktur (ähnlich wie FeS2), zwischen −77 °C und −50 °C in Pyritstruktur und oberhalb −50 °C ähnlich wie Kochsalz (NaCl).
Die Standardbildungsenthalpie von Natriumhyperoxid beträgt ΔHf0 = -260 kJ/mol.[3]
Zukünftige Anwendungen
Natriumhyperoxid ist derzeit Gegenstand der Akkuforschung. Bei der Entwicklung moderner Metall-Luft-Akkus zeigt sich ein großes Potential bezüglich Stabilität, Lade- und Entladeeffizienz.[6]
Siehe auch
Weblinks
- uni-Kiel: Alkalimetalle (PDF-Datei; 2,46 MB)
Einzelnachweise
- ↑ Eintrag zu Natriumoxide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- ↑ Natriumhyperoxid bei webelements.com
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1176.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Stephen E. Stephanou et al.: Sodium superoxide. In: J. C. Bailar, Jr. (Hrsg.): Inorganic Syntheses. Band 4. McGraw-Hill, Inc., 1953, S. 82–85 (englisch).
- ↑ P. Hartmann et al.: A rechargeable room-temperature sodium superoxide (NaO2) battery, Nature Materials 12, 2013, S. 228–232, doi:10.1038/nmat3486.
![{\displaystyle \mathrm {Na_{2}O_{2}+O_{2}\ {\xrightarrow[{138\ bar}]{450\,{}^{\circ }C}}\ 2\ NaO_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/19e04da534a74bc19d1440a294ae0b401b50d9ca)

