Natriummethanolat
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
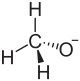 Natriumion Natriumion
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Natriummethanolat | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | CH3NaO | ||||||||||||
| Kurzbeschreibung |
farbloses bis gelbliches, hygroskopisches, geruchloses Pulver[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 54,02 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
1,3 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
Zersetzung in Wasser, gut löslich in wasserfreiem Methanol[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Natriummethanolat ist das Alkoholat des Methanols mit Natrium als Gegenion und das wichtigste der Methanolate.
Natriummethanolat sollte nicht mit Natriumethanolat (Summenformel C2H5NaO) verwechselt werden.
Darstellung
Die Herstellung der Verbindung erfolgt über die Reaktion von Methanol mit elementarem Natrium oder mit Natriumhydrid. Daneben entsteht molekularer Wasserstoff.
- Fehler beim Parsen (MathML mit SVG- oder PNG-Rückgriff (empfohlen für moderne Browser und Barrierefreiheitswerkzeuge): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle \mathrm{2 \ CH_3OH\ +\ 2 \ Na\longrightarrow\ 2 \ CH_3ONa\ +\ H_2}}
- Fehler beim Parsen (MathML mit SVG- oder PNG-Rückgriff (empfohlen für moderne Browser und Barrierefreiheitswerkzeuge): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle \mathrm{CH_3OH\ +\ NaH\longrightarrow\ CH_3ONa\ +\ H_2}}
Eigenschaften
Natriummethanolat ist ein stark hygroskopischer weißer Feststoff. Dieser ist sehr reaktiv und wird aus diesem Grund meist nur in Lösung gehandhabt und gelagert. Bei Temperaturen über 50 °C besteht an Luft die Gefahr der Selbstentzündung.
Es ist eine sehr starke Base, die heftig mit Wasser und Säuren reagiert.
Verwendung
Natriummethanolat wird als Base beispielsweise zur Deprotonierung CH-acider Verbindungen verwendet. Alternativ kann Lithiummethanolat verwendet werden.
Literatur
- Autorenkollektiv: Organikum. 22. Auflage. Wiley-VCH, 2004, ISBN 978-3-527-31148-4.
Einzelnachweise
- ↑ a b c d e f Eintrag zu Natriummethanolat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Eintrag zu Sodium methanolate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Datenblatt Natriummethanolat bei Merck, abgerufen am 18. Januar 2011.