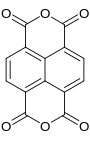
Napthalintetracarbonsäuredianhydrid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Napthalintetracarbonsäuredianhydrid | |||||||||||||||
| Andere Namen |
NTDA, NDA | |||||||||||||||
| Summenformel | C14H4O6 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 268.182 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,765 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt |
450 °C[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Napthalintetracarbonsäuredianhydrid ist eine organische Verbindung, die mit Naphthalin verwandt ist. Die Verbindung dient häufig als Präkursor (Vorläufer) für Napthalindiimide, eine Verbindungsklasse mit vielfältiger Anwendung.[4]
Herstellung
Napthalintetracarbonsäuredianhydrid wird durch Oxidation von Pyren hergestellt. Typische Oxidationsmittel sind Chromsäure und Chlor. Das ungesättigte Tetrachlorid hydrolisiert zum Enol, das zum bis-dion tautomerisiert, welches abschließend zur Tetracarbonsäure oxidiert und bei 80 °C unter Verlust zweier Moleküle Wasser zum Dianhydrid umgesetzt wird.[5]
Naphtalindiimide
Napthalintetracarbonsäuredianhydrid kann mit zahlreichen Aminen zu Naphtalindiimiden (NDI) kondensiert werden. Es wurde auch eine Vielzahl von Liganden mit NDI-Backbone hergestellt.[7] Symmetrische Naphthalindiimide werden direkt durch Kondensation mit primären Aminen synthetisiert. Für die Synthese von unsymmetrischen Derivaten (aus zwei unterschiedlichen Aminen abgeleitet) wird vor der Reaktion mit dem ersten Amin eine der beiden Anhydridgruppen hydrolysiert.
Naphtalindiimide (NDI) fluoreszieren oftmals, die Intensität ist jedoch von den Substituenten abhängig. NDIs sind auch redoxaktiv, sie bilden stabile Radikal-Anionen nahe −1,10 V (gegenüber Fc/Fc+).[4] Die Fähigkeit als Elektronenakzeptor zu wirken wird durch das ausgedehnte konjugierte System und die elektronenziehenden Gruppen verursacht. NDIs werden in der supramolekularen Chemie aufgrund ihrer Neigung zur Bildung von Charge-Transfer-Komplexen verwendet, bsp. mit Kronenethern zu Rotaxanen und Catenanen. Durch ihre planare Struktur und die Fähigkeit als Elektronenakzeptoren zu wirken, interkalieren sie in DNA. Napthalintetracarbonsäuredianhydrid wird in der Literatur umfangreich als p-type core in n-channel organischen Halbleiter diskutiert.[8]
Sowohl Napthalintetracarbonsäuredianhydrid als auch Naphtalindiimide sind verwandt mit den Rylen-Farbstoffen und Dianhydride und Diimide dieser Verbindungen sind ebenso bekannt.
Einzelnachweise
- ↑ A. C. Blackburn, L. J. Fitzgerald, R. E. Gerkin: 1,4,5,8-Naphthalenetetracarboxylic Acid Cyclic 1,8-Anhydride Bis(dimethyl sulfoxide) Solvate and 1,4,5,8-Naphthalenetetracarboxylic 1,8:4,5-Dianhydride. In: Acta Crystallographica Section C Crystal Structure Communications. Band 53, Nr. 12, 15. Dezember 1997, S. 1991–1995, doi:10.1107/S0108270197011712.
- ↑ Patent EP2399918: Ring Compound. Angemeldet am 19. Februar 2010, veröffentlicht am 26. Dezember 2012, Anmelder: Sumitomo Chemical CO, Erfinder: Masasoshi Iwata, Matsunaga Tadafumi, Koshino Nobuyoshi, Higashimura Hideyuki.
- ↑ a b Datenblatt 1,4,5,8-Naphthalenetetracarboxylic dianhydride bei Sigma-Aldrich, abgerufen am 23. Mai 2016 (PDF).
- ↑ a b Sheshanath V. Bhosale, Chintan H. Janiab, Steven J. Langford: Chemistry of Naphthalene Diimides. In: Chem. Soc. Rev. Nr. 37, 2008, S. 331–342, doi:10.1039/b615857a.
- ↑ Freimund Röhrscheid: Carboxylic Acids, Aromatic. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2012, doi:10.1002/14356007.a05_249.
- ↑ Mikio Yasutake, Takashi Fujihara, Akira Nagasawa, Keiichi Moriya, Takuji Hirose: Synthesis and Phase Structures of Novel π-Acceptor Discotic Liquid Crystalline Compounds Having a Pyrenedione Core. In: European Journal of Organic Chemistry. Band 24, 2008, S. 4120–4125, doi:10.1002/ejoc.200800360.
- ↑ Mei Pan, Xiao-Ming Lin, Guo-Bi Li, Cheng-Yong Su: Progress in the study of metal–organic materials applying naphthalene diimide (NDI) ligands. In: Coordination Chemistry Reviews. Band 255, Nr. 15–16, 2011, S. 1921–1936, doi:10.1016/j.ccr.2011.03.013.
- ↑ Christopher R. Newman, C. Daniel Frisbie, Demetrio A. da Silva Filho, Jean-Luc Brédas, Paul C. Ewbank, Kent R. Mann: Introduction to Organic Thin Film Transistors and Design of n-Channel Organic Semiconductors. In: Chemistry of Materials. Band 16, Nr. 23, November 2004, S. 4436–4451, doi:10.1021/cm049391x.


