Chloramin T
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Chloramin T | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C7H7ClNNaO2S | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff mit chlorähnlichem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 227,65 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
mäßig in Wasser (150 g·l−1 bei 20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Chloramin T bildet ein weißes kristallines Pulver mit schwachem chlorähnlichem Geruch, löst sich mäßig in Wasser (150 g/l bei 20 °C), und ist unlöslich in unpolaren organischen Lösungsmitteln. Es lässt sich unzersetzt aus heißem Wasser umkristallisieren, gibt beim Erhitzen bei ca. 60 °C sein Kristallwasser ab und kann ab 130 °C explosionsartig zerfallen. Bei einer Temperatur von ca. 167 °C zersetzt es sich explosionsartig.[2] An Luft zersetzt es sich allmählich.[4]
Herstellung
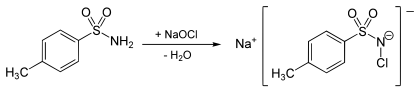
Chloramin T kann durch die Umsetzung von p-Toluolsulfonamid mit Natriumhypochlorit hergestellt werden. Natriumhypochlorit kann hierbei auch in situ aus Natronlauge und Chlor hergestellt werden.[5]
Weitere Eigenschaften
Chloramin T wirkt in wässriger Lösung wie Hypochlorit[5], besitzt demgegenüber jedoch den Vorteil der längeren Haltbarkeit. Außerdem ist es weniger aggressiv, z. B. gegen die Haut oder andere organische Materialien.
Da Chloramin T sich langsam an der Luft zersetzt und lichtempfindlich ist, muss es unbedingt dunkel gelagert und in einem gut verschlossenen Gefäß aufbewahrt werden. Die Haltbarkeit von Chloramin-T-Lösungen in 0,1- bzw. 2%iger Konzentration wird mit 2 Jahren angegeben.[6]
Verwendung
Medizin und Technik
Chloramin T besitzt eine hohe bakterizide Wirkung und ist ein kräftiges Oxidationsmittel. Es wird deshalb als Desinfektionsmittel, Antiseptikum und Desodorans in Medizin und Technik verwendet.[4]
Auch zur Aufbewahrung und Konservierung extrahierter Zähne vor der Weiterverwendung zu wissenschaftlichen Studienzwecken kann Chloramin T als Alternative zu Thymol eingesetzt werden.[7]
Nachweisreagenz
Chloramin T kann zum Nachweis von Bromid und Iodid in Lösung verwendet werden.
In wässriger Lösung entsteht Hypochlorit durch Hydrolyse, welches mit Salzsäure zu Chlor und Chlorid synproportioniert.
Entsprechend der elektrochemischen Spannungsreihe oxidiert das entstandene Chlor zunächst Iodide zu elementarem Iod und danach Bromide zu Brom. In organischen Lösemitteln wie n-Hexan, Dichlormethan oder Ether sind daraufhin die charakteristischen Färbungen zu erkennen.[8]
Siehe auch
Einzelnachweise
- ↑ Eintrag zu CHLORAMINE T in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. September 2021.
- ↑ a b c d e f Eintrag zu Chloramin T in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- ↑ Eintrag zu Tosylchloramide sodium im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Eintrag Chloramine T Trihydrate bei Chemicalland, abgerufen am 3. Februar 2018.
- ↑ a b M. Shetty, T. B. Gowda: A Study of Substituent Effect on the Oxidative Strengths of N-Chloroarenesulphonamides: Kinetics of Oxidation of Leucine and Isoleucine in Aqueous Acid Medium. In: Zeitschrift für Naturforschung B. 59, 2004, S. 63–72 (PDF, freier Volltext).
- ↑ ADKA Service-Abteilung(Hrsg.): Herstellungsvorschriften aus Krankenhausapotheken. Formularium hospitale, Loseblattsammlung (Stand: 6. Ergänzungslieferung 2005). Deutscher Apotheker Verlag, Stuttgart.
- ↑ Tobias André Mackert: Über die Haftkraft von adhäsiv befestigten Faserstiften nach künstlicher Alterung. (PDF; 13,9 MB) Zahnmed. Dissertation, Erlangen 2011. S. 6.
- ↑ Dirk Häffner: Arbeitsbuch qualitative anorganische Analyse. 2. überarbeitete Auflage, Govi-Verlag, ISBN 3-7741-0997-4, S. 124.