Natriumarsenid
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| _ Na+ _ As3− | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Natriumarsenid | ||||||||||||
| Andere Namen |
Trinatriumarsenid | ||||||||||||
| Verhältnisformel | AsNa3 | ||||||||||||
| Kurzbeschreibung |
braun violetter Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 143,89 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
2,36 g·cm−3[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Natriumarsenid ist eine anorganische chemische Verbindung des Natriums aus der Gruppe der Arsenide. Neben Na3As sind noch weitere Natriumarsenide wie NaAs bekannt.[4]
Gewinnung und Darstellung
Natriumarsenid kann durch Reaktion von Natriumdampf mit Arsen bei 180 bis 200 °C gewonnen werden.[5]
Eigenschaften
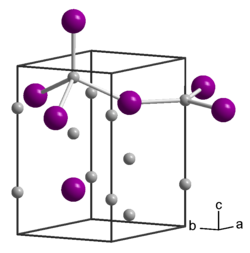
Natriumarsenid ist ein braun-violetter Feststoff. Er besitzt eine hexagonale Kristallstruktur mit der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) und den Gitterparametern a =4,874 Å und c = 8,515 Å.[6] Die Struktur enthält zwei kristallographisch verschiedene Na-Atome; eines ist trigonal-planar von As-Atomen umgeben, das andere tetraedrisch. Andere Literaturquellen berichten von einer Struktur vom Anti-Tysonit-Typ[1] mit der P63cm (Nr. 185).[7] Bei Kontakt mit Wasser bildet sich Arsenwasserstoff.[8][9]
Einzelnachweise
- ↑ a b c J. D. Smith: The Chemistry of Arsenic, Antimony and Bismuth: Pergamon Texts in Inorganic Chemistry. Elsevier, 2013, ISBN 978-1-4831-8754-9, S. 559 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Norbert Auner, Wolfgang A. Herrmann, Uwe Klingebiel: Synthetic Methods of Organometallic and Inorganic Chemistry, Volume 2, 1996: Volume 2: Groups 1,2, 13 and 14. Georg Thieme Verlag, 2014, ISBN 3-13-179171-3, S. 40 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ J. Songster, A. D. Pelton: The As-Na (arsenic-sodium) system. In: Journal of Phase Equilibria. 14, 1993, S. 240, doi:10.1007/BF02667819.
- ↑ William A. Hart, O. F. Beumel, Thomas P. Whaley: The Chemistry of Lithium, Sodium, Potassium, Rubidium, Cesium and Francium: Pergamon Texts in Inorganic Chemistry. Elsevier, 2013, ISBN 978-1-4831-8757-0, S. 439 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ H.J. Beister, K. Syassen, J. Klein: Phase transition of Na3As under pressure. In: Zeitschrift für Naturforschung B. 45, 1990, S. 1388–1392 (PDF, freier Volltext).
- ↑ Bodie Douglas, Shi-Ming Ho: Structure and Chemistry of Crystalline Solids:. Springer Science & Business Media, 2007, ISBN 978-0-387-36687-6, S. 323 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Amit Arora: Text Book Of Inorganic Chemistry:. Discovery Publishing House, 2005, ISBN 978-81-8356-013-9, S. 521 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Peter Hafner, Klaus-Jürgen Range: Na3As revisited: high-pressure synthesis of single crystals and structure refinement. In: Journal of Alloys and Compounds. 216, 1994, S. 7, doi:10.1016/0925-8388(94)91033-2.

