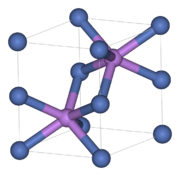
Nickelarsenid
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
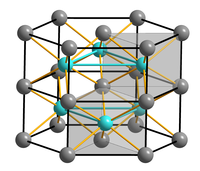
| ||||||||||
| _ Ni3+ _ As3− | ||||||||||
| Allgemeines | ||||||||||
| Name | Nickelarsenid | |||||||||
| Andere Namen |
| |||||||||
| Verhältnisformel | NiAs | |||||||||
| Kurzbeschreibung |
roter Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 133,62 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
7,57 g·cm−3 (20 °C)[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser (20 °C)[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Nickelarsenid NiAs ist eine Verbindung der Elemente Nickel und Arsen und existiert als roter metallischer Feststoff. NiAs ist der Prototyp einer AB-Struktur mit hexagonal-dichtester Kugelpackung.
Vorkommen
Nickelarsenid kommt als Mineral Nickelin (auch Nickelit oder Rotnickelkies) vor, in dem aber auch schwankende Anteile von Eisen, Schwefel und Antimon vorhanden sind.
Nickelarsenid-Struktur
Die NiAs-Struktur mit ihrer hexagonal-dichtester Kugelpackung (Schichtfolge ABAB) der „Anionen“ stellt nach der kubischen NaCl-Struktur den häufigsten AB-Strukturtyp dar, den viele Chalkogenide, Arsenide, Antimonide und Bismutide der Übergangsmetalle annehmen. Die Bindung zwischen Nickel und Arsen hat nur einen geringen ionischen Anteil und besitzt bereits einen starken metallischen Charakter. NiAs kristallisiert im hexagonalen Kristallsystem in der Raumgruppe P63/mmc (Raumgruppen-Nr. 194). Die Elementarzelle besitzt die Gitterparameter a = b = 361,8 pm, c = 503,4 pm, α = β = 90° und γ = 120°. Die Nickel-„Kationen“ befinden sich hierbei in den von sechs Arsen-„Anionen“ gebildeten Oktaederlücken der hexagonal dichtesten Kugelpackung, während die Arsenatome von sechs Nickelatomen umgeben sind, die ihrerseits ein trigonales Prisma bilden. Für beide Atomsorten ergibt sich dadurch eine Koordinationszahl von 6 (Koordination = 6:6). Die Verwandtschaft der NiAs-Struktur zur ebenfalls hexagonalen Cadmiumiodidstruktur besteht darin, dass bei Weglassen der Kationen in jeder zweiter Oktaederlückenschicht eine AB2-Schichtstruktur vom CdI2-Typ entsteht.
Folgende anorganische Verbindungen bzw. Minerale kristallisieren in der NiAs-Struktur:
- Monochalkogenide der Übergangsmetalle der 4. Periode:
- Zahlreiche Pnictogenide (Verbindungen mit Anionen der 5. Hauptgruppe):
- Phosphide: VP
- Arsenide: TiAs, MnAs, CoAs, NiAs
- Antimonide: TiSb, VSb, CrSb, MnSb, FeSb, CoSb, NiSb, IrSb, PdSb, PtSb
- Bismutide: MnBi, NiBi, RhBi, InBi, PtBi
- Weitere Minerale: Langistit (Co,Ni)As, Pyrrhotin Fe1-xS, Stumpflit Pt(Sb,Bi), Sudburyit (Pd,Ni)Sb
Eigenschaften, Verwendung und Sicherheitshinweise
Nickelarsenid wird als Katalysator bei der Entfernung von Metallverunreinigungen aus Kohlenwasserstoffen eingesetzt. Schon aufgrund seiner akuten Toxizität sollte jeglicher Kontakt, z. B. der Haut und der Augen, mit Nickelarsenid vermieden werden. Besonders gefährlich ist die Freisetzung noch giftigerer Nickelverbindungen im Brandfall oder durch Säuren. Im Gegensatz zu vielen anderen Nickelverbindungen scheint Nickelarsenid in manchen Tierversuchen nicht krebserregend zu wirken, jedoch wurde eine Wirkung als krebserregend für den Menschen nachgewiesen. Trotz der Unlöslichkeit von Nickelarsenid in Wasser geht von der Verbindung eine große Gefahr für Wasserorganismen aus.
Einzelnachweise
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1716.
- ↑ a b c Sicherheitsdatenblatt (Memento des Originals vom 27. September 2007 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Eintrag zu CAS-Nr. 27016-75-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Eintrag zu Nickel arsenide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1., korr. Auflage. VCH, Weinheim/ Basel/ Cambridge/ New York 1990, ISBN 3-527-26169-9.
Weblinks
- Interaktive Kristallstrukturseite (engl., weitgehend selbsterklärend)
- Patent US4551230A: Demetallization of hydrocarbon feed streams with nickel arsenide. Angemeldet am 1. Oktober 1984, veröffentlicht am 5. November 1985, Anmelder: Phillips Petroleum Co, Erfinder: Simon G. Kukes, Gerhard P. Nowack.
- Angaben zum krebserregenden Potential (engl.)