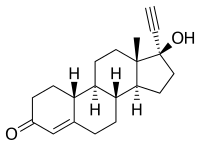
Norethisteron
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Norethisteron | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C20H26O2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 298,42 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Norethisteron (auch Norethindron) ist ein Arzneistoff aus der Gruppe der synthetisch hergestellten Gelbkörperhormone (Gestagene) der 1. Generation. Norethisteron wird zur Empfängnisverhütung verwendet – meistens in Kombination mit einem Östrogen (Antibabypille), aber auch allein (Minipille, Dreimonatsspritze). Ferner ist es Bestandteil von Arzneimitteln zur Behandlung klimakterischer Beschwerden (postmenopausale Hormonersatzbehandlung).
Geschichte
Norethisteron war das erste oral wirksame synthetische Progestin.
Es wurde erstmals 1951 von Carl Djerassi, Luis E. Miramontes und George Rosenkranz bei Syntex in Mexiko-Stadt synthetisiert.[4]
Neben seinem Einsatzgebiet in der Empfängnisverhütung wurde Norethisteron hochdosiert in Kombination mit Ethinylestradiol bis 1978 unter dem Markennamen Duogynon und bis 1981 unter dem Namen Cumorit als Schwangerschaftstest und zur Behandlung von Menstruationsstörungen (sekundäre Amenorrhoe) und – wie aus der feministischen Frauenliteratur der 1970er Jahre zu folgern ist – wohl auch missbräuchlich zum Schwangerschaftsabbruch verwendet. Beim Off-Label-Use Schwangerschaftsabbruch wurde eine Überdosierung von 4 oder 6 Dragees Duogynon statt der üblichen 2 Dragees verwendet.
Duogynon-Skandal
Schering vertrieb bis 1978 in der Bundesrepublik Deutschland unter dem Markennamen Duogynon und bis 1981 unter dem Namen Cumorit ein Hormonmittel in zwei Applikationsformen (Dragees und Spritzampullen). Duogynon, in der frühen Schwangerschaft[5] eingenommen, wurde schon 1967 mit einer Häufung von fehlgebildeten Kindern in Verbindung gebracht.
Chemisch-pharmazeutische Informationen
Norethisteron ist ein Abkömmling des Nortestosterons. Durch die am C-17 eingeführte Ethinylgruppe ist es im Gegensatz zu Progesteron oral wirksam. Arzneilich verwendet werden neben dem Norethisteron selbst auch seine Ester der Essigsäure (Norethisteronacetat) und der Enanthsäure (Norethisteronenantat).
Pharmakologische Eigenschaften
Die Wirkungen des Norethisterons entsprechen weitgehend – indes nicht in allen Eigenschaften – denen des Progesterons, das heißt, Norethisteron fördert das Wachstum der Uterusmuskulatur und der Milchbildungszellen in den Brüsten. Die synthetisierte Substanz hemmt die Zellproliferation der Gebärmutterschleimhaut und fördert deren Sekretionssphase. Norethisteron bewirkt, dass der am Gebärmuttermund gebildete Schleim zähflüssiger wird und damit für Spermien undurchdringbar. Es hemmt die Ausschüttung von luteinisierendem Hormon (LH) aus dem Vorderlappen der Hirnanhangsdrüse (Adenohypophyse) und unterdrückt dadurch den Eisprung (Ovulation).[6][7]
Wegen der Strukturverwandtschaft mit Nortestosteron hat Norethisteron ferner eine androgene Wirkung.
Norethisteron und Norethisterinacetat werden aus dem Magen-Darm-Trakt schnell resorbiert. Die Esterverbindung wird rasch hydrolysiert, wobei das pharmakologisch aktive Norethisteron entsteht. Die Plasmahalbwertszeit liegt bei 4 bis 13 Stunden.[6]
Die zusätzliche Ethinylgruppe am C-17 beeinflusst insbesondere die pharmakokinetischen Eigenschaften: so unterliegt Norethisteron im Vergleich zu Progesteron einem verminderten First-Pass-Effekt in der Leber, mit der Folge einer deutlich erhöhten oralen Bioverfügbarkeit. Inwiefern aufgrund des verminderten Abbaus der Substanz im menschlichen oder auch im tierischen Organismus eine Kumulation des Arzneistoffs stattfindet, ist bisher weitgehend ungeklärt.
Klinische Angaben
Norethisteron/ Norethisteronacetat wird oft in Kombination mit einem Östrogen verwendet, etwa in Dosen von 0,5 bis 1 mg zur hormonellen Empfängnisverhütung und in Dosen von 1 bis 2 mg in der Hormonersatztherapie. Ebenfalls zur Schwangerschaftsverhütung wird Norethisteron als Monopräparat in Dosen von 0,35 mg in der „Minipille“ eingesetzt und mit 200 mg Norethisteronenantat in der Dreimonatsspritze, einem öligen Injektionsdepot zur intramuskulären Anwendung.[7]
Als weitere Anwendungsgebiete für Norethisteron gelten dysfunktionelle Blutungen, Endometriose und fortgeschrittener Brust- oder Gebärmutterkrebs.[7]
Gegenanzeigen für die Behandlung mit Norethisteron sind in erster Linie, wie für die Behandlung mit anderen Gestagenen auch, thromboembolische Erkrankungen, schwere Leberfunktionsstörungen und Hyperbilirubinämie. Wegen des Risikos einer Vermännlichung (Maskulinisierung) weiblicher Föten ist Norethisteron in der Schwangerschaft kontraindiziert.[7]
Als Nebenwirkungen können Übelkeit und Erbrechen, Kopfschmerzen, Hautausschlag, depressive Verstimmungen und Spannungsgefühl in den Brüsten auftreten. Auch eine verminderte Libido und Gewichtszunahme können als Folge einer Behandlung mit Norethisteron auftreten.[7][6]
Handelsnamen
Micronovum (A, CH), Noristerat (D), Primolut (CH) und Generika
Activelle (D, A, CH), Clionara (D), Cliovelle (D), Duogynon (D), Duokliman (A), Estalis (D, A, CH), Estracomb (A, CH), Estragest (D, CH), Estranor (CH), EVE (D), Gynamon (D), Kliogest (D, A, CH), Mericomb (D, A, CH), Merigest (D, A, CH), Novofem (D, CH), Ovysmen (A), Perikliman (A), Primodos (GB), Primosiston (A, CH), Sequidot (D, A, CH), Systen (CH), Trinovum (A, CH), Trisequenz (A, CH), Conceplan M (D)
Literatur
- Eckart Roloff und Karin Henke-Wendt: Duogynon – nochmals Contergan, aber fast geheim? In: dies., Geschädigt statt geheilt. Große deutsche Medizin- und Pharmaskandale. Hirzel, Stuttgart 2018, S. 49–63, ISBN 978-3-7776-2763-2.
Weblinks
Zu Scherings Duogynon-Skandal in Deutschland:
- Deutschlandradio Kultur (4. Juli 2016) Der Fall Duogynon – ein wenig beachteter Medikamentenskandal (mit Audio)
- Duogynon-Kampagneseite der Coordination gegen Bayer-Gefahren
- Website von durch Duogynon Geschädigten
Zur britischen Untersuchung von Scherings Schwangerschaftstest Primodos:
- The Guardian (13. Oktober 2016) Primodos was a revolutionary oral pregnancy test. But was it safe?
- sky NEWS (13. Oktober 2016) Primodos 'victims' losing confidence in drug inquiry (A documentary is in the works)
Filmdokumentation:
- Die Story im Ersten (28. November 2016) Der vertuschte Skandal – Ein Pharmakonzern und sein Hormonpräparat auf YouTube
Einzelnachweise
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 0-911910-00-X, S. 1157.
- ↑ a b Datenblatt 19-Norethindrone bei Sigma-Aldrich, abgerufen am 10. November 2021 (PDF).
- ↑ Datenblatt NORETHISTERONE CRS (PDF) beim EDQM, abgerufen am 2. August 2008.
- ↑ C. Djerassi, L. Miramontes, G. Rosenkranz, F. Sondheimer: Steroids. LIV. Synthesis of 19-Nor-17α-ethynyltestosterone and 19-Nor-17α-methyltestosterone. In: J Am Chem Soc. Band 76, Nr. 16, 1954, S. 4089–4091, doi:10.1021/ja01645a010.
- ↑ G. Tümmler, C. Schaefer: Duogynon: Angeborene Fehlbildungen nach Applikation der Östrogen-Progesteron-Kombination in der Schwangerschaft – Auswertung einer retrospektiven Fallserie. Abgerufen am 18. März 2020. In: Bulletin zur Arzneimittelsicherheit. Bundesinstitut für Arzneimittel und Medizinprodukte und Paul-Ehrlich-Institut, Ausgabe 4, Dezember 2012, S. 20–23.
- ↑ a b c E. Mutschler, G. Geisslinger, H. K. Kroemer, P. Ruth, M. Schäfer-Korting: Arzneimittelwirkungen. Lehrbuch der Pharmakologie und Toxikologie. 9. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2008, ISBN 978-3-8047-1952-1, S. 453.
- ↑ a b c d e K. Hardtke u. a. (Hrsg.): Kommentar zum Europäischen Arzneibuch Ph. Eur. 4.0, Cortisonacetat. Loseblattsammlung, 25. Lieferung 2006, Wissenschaftliche Verlagsgesellschaft, Stuttgart.