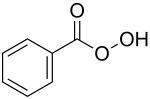
Peroxybenzoesäure
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Peroxybenzoesäure | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C7H6O3 | ||||||||||||
| Kurzbeschreibung |
farblose, stechend riechende Kristalle, sehr flüchtig[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 138,12 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Die Peroxybenzoesäure (veraltet: Perbenzoesäure) ist eine organische Säure, die ein Derivat der Benzoesäure darstellt. Sie gehört zur Gruppe der Peroxycarbonsäuren.
Eigenschaften
Peroxybenzoesäure liegt bei Raumtemperatur in Form von farblosen, stechend riechenden Kristallen vor und ist sehr flüchtig. Ihr Schmelzpunkt liegt bei 41–43 °C. Sie ist in Wasser nur wenig, in organischen Lösungsmitteln hingegen leicht löslich.
Verwendung
Sie ist ein starkes Oxidationsmittel und findet daher vielseitige Anwendungen.
Mit Alkenen ergibt Peroxybenzoesäure Epoxide (Prileschajew-Reaktion), weswegen sie in der analytischen Chemie zur Bestimmung des Gehalts an Doppelbindungen verwendet wird.[1]
Herstellung
Peroxybenzoesäure wird aus Dibenzoylperoxid und Natriumethanolat in Ethanol hergestellt.[1]
Die Bildung von Peroxybenzoesäure bei der Oxidation von Benzaldehyd mit Wasserstoffperoxid wurde von Hermann Staudinger bereits 1913 beschrieben.[3]
Einzelnachweise
- ↑ a b c d e f J. Falbe, M. Regitz (Hrsg.): Römpp Lexikon Chemie. 10. Aufl., Thieme, Stuttgart u. New York, 1996–1999. S. 3205.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ H. Staudinger: Über die Autoxydation organischer Verbindungen I. Über die Autoxydation aromatischer Aldehyde. In: Berichte der deutschen chemischen Gesellschaft. Band 46, Nr. 3, Juli 1913, S. 3530–3535, doi:10.1002/cber.191304603134.