Peterson-Olefinierung
Die Peterson-Olefinierung (auch Peterson-Reaktion oder Peterson-Eliminierung, nach Donald John Peterson) ist eine Namensreaktion aus der Organischen Chemie. Ein α-silyliertes Carbanion wird mit einem Keton (oder Aldehyd) zu einem Alken als Reaktionsprodukt eliminiert. Die Reaktionsführung kann hierbei unterschiedlich verlaufen, je nachdem ob die Reaktion sauer oder basisch stattfindet.[1]
Reaktionsmechanismus
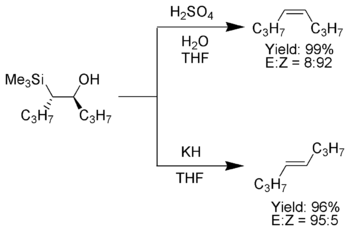
Die Peterson-Olefinierung ist eine wichtige Reaktion der organischen Synthesechemie, da mit ihr diastereoselektiv cis- oder trans-Alkene aus β-Hydroxysilanen synthetisiert werden können. Aufarbeitung des β-Hydroxysilans mit Säure ergibt das eine Alken, während Aufarbeitung desselben β-Hydroxysilans mit Base das Alken mit entgegengesetzter Stereochemie ergibt.
- Saure Eliminierung (oben):
Die Behandlung des β-Hydroxysilans mit Säure resultiert über die Protonierung in einer anti-Eliminierung.
- Basische Eliminierung (unten):
Der Einfluss der Base auf das β-Hydroxysilan führt zu einer konzertierten syn-Eliminierung.
Da bereits im ersten Schritt zwei unterschiedliche Stereoisomere entstehen können, existieren insgesamt vier mögliche Reaktionswege:
Alkylsubstituenten
Trägt das α-silyl-Carbanion nur alkyl-, wasserstoff, oder elektronenspendende Substituenten, kann die Stereochemie der Peterson-Olefinierung kontrolliert werden,[2] da bei ausreichend niedriger Temperatur die Eliminierung so langsam verläuft, dass das intermediäre β-Hydroxysilan isoliert werden kann.
Einmal isoliert, können die diastereomeren β-Hydroxysilane getrennt werden. Ein Diastereomer wird mit Säure behandelt, während das andere mit Base behandelt wird, was in der diastereoselektiven Erzeugung von cis- und trans-Alken resultiert.[3]
Elektronenziehende Substituenten
Trägt das α-silylierte-Carbanion elektronen-ziehende Substituenten ist das β-Hydroxysilan-Intermediat zu instabil um isoliert werden zu können, es bildet sich umgehend das Alken.
Literatur
Übersichtsartikel:
- D. J. Ager: The Peterson Reaction. In: Synthesis. Nr. 5, 1984, S. 384–398.
- D. J. Ager: The Peterson Olefination Reaction. In: Organic Reactions. Band 38, 1990, S. 1–223.
- T.-H. Chan: Alkene synthesis via .beta.-functionalized organosilicon compounds. In: Accounts of Chemical Research. Band 10, 1977, S. 442–448.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, 2005, ISBN 0-12-429785-4, S. 344–345.
Siehe auch
Einzelnachweise
- ↑ D. J. Peterson: Carbonyl olefination reaction using silyl-substituted organometallic compounds. In: The Journal of Organic Chemistry. Band 33, 1968, S. 780.
- ↑ Anthony G. M. Barrett, John A. Flygare, Jason M. Hill, Eli M. Wallace: Stereoselective Alkene Synthesis via 1-Chloro-1-((Dimethyl)Phenylsilyl)Alkanes AND α-(Dimethyl)Phenylsilyl Ketones: 6-Methyl-6-Dodecene In: Organic Syntheses. Band 73, 1996, S. 50, Modul:Vorlage:Handle * library URIutil invalid; Coll. Vol. 9, 1998, S. 580 (PDF).
- ↑ D. J. Ager: The Peterson Olefination Reaction. In: Organic Reactions. Band 38, 1990, S. 1–223.