Phosphaalkine
Phosphaalkine (englisch phosphaalkyne) sind chemische Verbindungen, welche eine Kohlenstoff-Phosphor-Dreifachbindung enthalten.
Die Stammverbindung, Methinophosphid oder Phosphaethin (H–C≡P) ist äußerst instabil. Die erste Gewinnung erfolgte durch elektrische Entladungen zwischen Graphitelektroden in einer Phosphin-Atmosphäre. Die Verbindung wurde bei −196 °C ausgefroren und mittels IR-Spektroskopie charakterisiert (1961 von T. E. Gier von DuPont).[1] Die Verbindung kann als farbloser Feststoff bei Temperaturen unterhalb von −124 °C gelagert werden. Bei höheren Temperaturen erfolgt eine Polymerisation.[1] Phospaethin und daraus entstandenes frisches Polymer ist an der Luft pyrophor.[1] Eine Reihe von Phosphaalkinen wurden als sehr kurzlebige Intermediate bei Gasphasenpyrolysen beobachtet.
| Kurzlebige Phosphaalkinderivate (P≡C-R)[2][3] | ||||||||||||
| a | b | c | d | e | f | g | ||||||
| R | –F | –CH3 | –CF3 | –CH=CH2 | –C≡H | –C≡C–C≡N | –C≡N | |||||
| Pyrolysebedingungen | 25 °C/0,03 Torr/KOH | 900 °C/0,03 Torr | 1000 °C/0,03 – 0,06 Torr | 1000 °C/0,03 – 0,06 Torr | 1100 °C/0,03 – 0,06 Torr | 1100 °C/0,08 Torr | 700 °C | |||||
| Quelle | [4] | [5] | [6] | [6] | [6] | [7] | [8] | |||||
Die Ausgangsstoffe können bei diesen bei hohen Temperaturen und niedrigen Drücken durchgeführten Pyrolysen entsprechende Alkylphosphordichloride oder das Trifluormethylphosphin sein.
- Fehler beim Parsen (MathML mit SVG- oder PNG-Rückgriff (empfohlen für moderne Browser und Barrierefreiheitswerkzeuge): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle \mathrm{F_3C{-}PH_2 \rightarrow F{-}C{\equiv}P + 2\ HF}}
Konjugierte Phosphaalkine können über eine Copyrolyse mit Phosphortrichlorid erhalten werden.
- Fehler beim Parsen (MathML mit SVG- oder PNG-Rückgriff (empfohlen für moderne Browser und Barrierefreiheitswerkzeuge): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle \mathrm{HC{\equiv}C{-}CH_2Cl + PCl_3 \rightarrow HC{\equiv}C{-}C{\equiv}P + 2\ HCl + Cl_2}}
- Fehler beim Parsen (MathML mit SVG- oder PNG-Rückgriff (empfohlen für moderne Browser und Barrierefreiheitswerkzeuge): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle \mathrm{N{\equiv}C{-}C{\equiv}C{-}CH_3 + PCl_3 \rightarrow N{\equiv}C{-}C{\equiv}C{-}C{\equiv}P + 3\ HCl}}
Schließlich kann Phosphaethin mittels Cyanazid radikalisch substituiert werden.
- Fehler beim Parsen (MathML mit SVG- oder PNG-Rückgriff (empfohlen für moderne Browser und Barrierefreiheitswerkzeuge): Ungültige Antwort („Math extension cannot connect to Restbase.“) von Server „https://wikimedia.org/api/rest_v1/“:): {\displaystyle \mathrm{2\ N{\equiv}C{-}N_3 + 2\ HC{\equiv}P \rightarrow 2\ N{\equiv}C{-}C{\equiv}P + 3\ N_2 + H_2}}
Als etwas länger lebige Verbindungen wurden das Phenylphosphaethin mit einer Halbwertszeit von 7 min bei 0 °C[9] und das Trimethylsilylphosphaethin mit einer Halbwertszeit von 50 min bei 20 °C[10] gefunden. Das erste bei Raumtemperatur stabile Phosphaethin tert-Butylphosphaethin wurde 1981 beschrieben und hinsichtlich seiner Eigenschaften untersucht.[11] Noch stabiler ist das Adamant-1-ylphosphaethin, welches farblose Kristalle mit einem Schmelzpunkt bei 69 – 70 °C bildet, die unzersetzt sublimierbar sind.[2]
Ein Bis(phosphaalkin) wurde, ebenso wie das erste stabile Bis(phosphaalken), von Veeck im Jahre 1996 hergestellt, jedoch nicht veröffentlicht. Als sterisch anspruchsvolles Gerüst zur Vermeidung sowohl intra- als auch intermolekularer Weiterreaktion wurde das Adamantangerüst eingesetzt. So konnte ausgehend von Adamantan-1,3-dicarbonsäuredichlorid durch Umsetzung mit Tris(trimethylsilyl)phosphin zunächst das Adamantan-1,3-bis(phosphaethen) und aus diesem durch Hexamethyldisiloxan-Eliminierung das Adamantan-1,3-bisphosphaethin gewonnen werden.[12] Jedoch war das Bis(phosphaalkin) nicht stabil und es kam zu einer intramolekularen Umlagerung.
Im Jahre 2003 konnte das erste wirklich stabile Diphosphaalkin realisiert, charakterisiert und mittels Einkristalldiffraktometrie analysiert werden. Dieses wurde dann auch in der Fachliteratur veröffentlicht.[13] Die Synthese des ersten stabilen Diphosphaalkins gelang durch den Einsatz des sterisch anspruchsvollen Triptycen-Gerüsts als Grundkörper. So konnte verhindert werden konnte, dass intramolekulare Reaktionen zwischen den beiden reaktiven P≡C-Gruppen stattfinden.
- 1,3-Bis(phosphaethinyl)adamantane Structural Formula V1.svg
1,3-Bis(phosphaethinyl)adamantan
9,10-Bis(phosphaethinyl)triptycen
Phosphaalkine können als Ausgangsstoffe für die Synthese von Phosphor enthaltenden Heterocyclen dienen. So bilden sich in [3+2]-Cycloadditionsreaktionen mit Nitriloxiden 1,2,4-Oxazaphosphole 1, mit Methylazid 1,2,3,4-Triazaphosphole 2 und mit Diazoalkanen 1,2,4-Diazaphosphole 3.[2]
Einzelnachweise
- ↑ a b c T. E. Gier: HCP, A Unique Phosphorus Compound. In: Journal of the American Chemical Society, 1961, 83 (7), 1769–1770; doi:10.1021/ja01468a058.
- ↑ a b c Allspach, T.; Regitz, M.; Becker, G.; Becker, W.: A Unusually Coordinated Phosphorus Compounds; 7. Adamant-1-ylmethylidynephosphine, A New, Stable Phosphaalkyne in Synthesis 1986, 31–36, doi:10.1055/s-1986-31467.
- ↑ Regitz, M.; Binger, P.: Phosphaalkine - Synthesen, Reaktionen, Koordinationsverhalten in Angew. Chem. 100 (1988) 1541–1565.
- ↑ Eshtiag-Hosseini, H., Kroto, H.W.; Brownstein, S.; Morton, J.R.; Preston, K.F.: 19F and 31P n.m.r. characterisation of phospha-alkene and phospha-alkyne intermediates in the alkaline hydrolysis of trifluoromethylphlphosphine in J. Chem. Soc. Chem. Commun. 1979, 653–654, doi:10.1039/C39790000653.
- ↑ Hopkinson, M.J., Kroto, H.W.; Nixon, J.F.; Simmons, N.P.C.: The detection of the reactive molecule 1-phosphapropyne, CH3–C≡P, by microwave spectroscopy in Chem. Phys. Lett. 42 (1976) 460–461, doi:10.1016/0009-2614(76)80653-7.
- ↑ a b c Burckett St. Laurent, J.C.T.R.; Cooper, T.A.; Kroto, H.W.; Nixon, J.F.; Ohashi, O.; Ohno, K.: The detection of some new phosphaalkynes, RCP, using microwave spectroscopy in J. Mol. Struct. 79 (1982) 215–220, doi:10.1016/0022-2860(82)85054-0.
- ↑ Durrant, M.C.; Kroto, H.W.; McNaughton, D.; Nixon, J.F.: The new molecule 1-cyano-4-phosphabutadiyne, produced by copyrolysis of PCl3 and CH3–C≡C–C≡N: Detection and vibration-rotation analysis by microwave spectroscopy in J. Mol. Spectrosc. 109 (1985) 8–14, doi:10.1016/0022-2852(85)90046-3.
- ↑ Cooper, T.A.; Kroto, H.W.; Nixon, J.F.; Ohashi, O.: Detection of C-cyanophosphaethyne, N≡C–C≡P, by microwave spectroscopy in J. Chem. Soc. Chem. Commum. 1980, 333–334, doi:10.1039/C39800000333.
- ↑ Appel, R. Meier, G.;Reisenauer, H.P.; Westerhaus, A.: in Angew. Chem. Int. Ed. 20 (1981) 197.
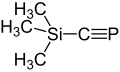
- ↑ Appel, R.; Westerhaus, A.: (CH3)3Si--C≡P, ein silylfunktionelles Phospha-alkin in Tetrahedron Lett. 22 (1981) 2159–2160, doi:10.1016/S0040-4039(01)90486-1.
- ↑ G. Becker, G. Gresser und W. Uhl: 2,2-Dimethylpropylidinphosphan, eine stabile Verbindung mit einem Phosphoratom der Koordinationszahl 1. In: Zeitschrift für Naturforschung B. 36, 1981, S. 16–19 (PDF, freier Volltext).
- ↑ Veeck, W.-G.: 1,2,4-Diazaphosphole mit Phosphanyl- und Arsanylsubstituenten [mit einem Anhang über ein Bis(phosphaalkin)]. Dissertation, Universität Kaiserslautern, 1997.
- ↑ M. Brym, C. Jones: Synthesis, characterisation and reactivity of the first diphosphaalkyne. In: Journal of the Chemical Society, 2003, 3665–3667; doi:10.1039/b309061b.