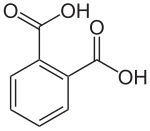
Phthalsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Phthalsäure (genauer ortho-Phthalsäure) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Phthalsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H6O4 | ||||||||||||||||||
| Kurzbeschreibung |
monokline, farblose Tafeln, Nadeln oder Schuppen[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 166,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,59 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
zersetzt sich beim Erhitzen[2] | ||||||||||||||||||
| pKS-Wert | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 5 mg·m−3 (gemessen als einatembarer Staub)[5] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Phthalsäure [ˈftaːl…] ist eine Chemikalie, die in der Chemie zu den Carbonsäuren, genauer den Dicarbonsäuren, zählt. Üblicherweise wird mit Phthalsäure die ortho-Phthalsäure bezeichnet, die neben der Terephthalsäure die größte technische Bedeutung hat. Der mengenmäßig größte Teil der Phthalsäuren wird zur Herstellung von Kunstharzen oder Kunstfasern verwendet. Die Salze und Ester der Phthalsäuren werden Phthalate genannt.
Phthalsäure umfasst als Begriff die Gruppe der drei stellungsisomeren Benzoldicarbonsäuren, die sich durch die Anordnung der beiden Carbonsäuregruppen unterscheiden. Im Einzelnen sind dies:
- 1,2-Benzoldicarbonsäure (ortho-Phthalsäure, o-Phthalsäure)
- 1,3-Benzoldicarbonsäure (Isophthalsäure, m-Phthalsäure)
- 1,4-Benzoldicarbonsäure (Terephthalsäure, p-Phthalsäure)
Geschichte
o-Phthalsäure wurde 1836 von Auguste Laurent bei der Oxidation von 1,2,3,4-Tetrachlor-1,2,3,4-tetrahydronaphthalin mit Salpetersäure entdeckt[6], trägt also ihren Namen nach diesem Kohlenwasserstoff.
Herstellung
o-Phthalsäure wurde lange Zeit nur durch Oxidation von Naphthalin mit Oleum nach einem von Eugen Sapper entwickelten Verfahren hergestellt; heute allerdings wird bei weitem überwiegend o-Xylol als Rohstoff verwendet. Ebenso wird Isophthalsäure aus m-Xylol und Terephthalsäure aus p-Xylol hergestellt.[7][8]
Eigenschaften
o-Phthalsäure ist ein farbloser, kristalliner Feststoff. In Wasser ist die Säure in geringem Maße löslich.
Sie kristallisiert im monoklinen Kristallsystem in der Raumgruppe C2/c (Raumgruppen-Nr. 15) mit den Gitterparametern a = 500 pm, b = 1420 pm, c = 960 pm und β = 93,5°. In der Elementarzelle befinden sich vier Formeleinheiten.[9]
Verwendung
o-Phthalsäure ist Rohstoff für die Herstellung von Polyesterharzen. Dabei wird die Phthalsäure oder meist deren Anhydrid mit mehrwertigen Alkoholen, z. B. Glycerin, verestert. Durch Verkochung von mehrfach ungesättigten Pflanzenölen wie Leinöl mit Phthalsäure und mehrwertigen Alkoholen werden Alkydharze durch Umesterung hergestellt. Phthalsäure ist auch Ausgangsstoff zur Darstellung vieler Farbstoffe, Farbpigmente oder Weichmacher. Einige der als Weichmacher eingesetzten Phthalsäureester sind als gesundheitsgefährdend umstritten (Endokrine Disruptoren). Über die Zwischenstufe Phthalsäuredinitril oder Phthalsäureanhydrid können die thermisch sehr beständigen Phthalocyanine hergestellt werden. Aus dem Phthalsäureanhydrid gelangt man durch Friedel-Crafts-Acylierung von Benzol zu Anthrachinon, aus dem Küpenfarbstoffe hergestellt werden können.
Einzelnachweise
- ↑ a b c Eintrag zu Phthalsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. Juli 2014.
- ↑ a b c d e f Eintrag zu Phthalsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Januar 2020. (JavaScript erforderlich)
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ chem.wisc.edu: pKa Data, Compiled by R. Williams (PDF; 645 kB).
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 88-99-3 bzw. Phthalsäure), abgerufen am 2. November 2015.
- ↑ Paul Karrer, Lehrbuch der Organischen Chemie, Georg Thieme Verlag, 1941.
- ↑ Eintrag zu Isophthalsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. Juli 2014.
- ↑ Eintrag zu Terephthalsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. Juli 2014.
- ↑ T. G. D. van Schalkwyk: The Crystal Structure of Phthalic Acid, in: Acta Cryst., 1954, 7, S. 775; doi:10.1107/S0365110X54002344.

